Понятие о молекуле (и производные от него представления о молекулярном строении материи, строении самой молекулы) позволяет понять свойства веществ, из которых состоит мир. Современные, как и ранние, физические и химические исследования зависят от великолепных открытий атомной и молекулярной структуры материи и основаны на них. Молекула — это единая «деталь» всех веществ, существование которой предположил Демокрит. Поэтому именно его строение и взаимоотношения с другими молекулами (образующими определенную структуру и состав) определяют/объясняют все различия между веществами, их типом и свойствами.
Сама молекула, не являющаяся мельчайшим компонентом вещества (которым является атом), имеет определенное строение и свойства. Строение молекулы определяется количеством входящих в нее определенных атомов и характером связи (ковалентной) между ними. Этот состав остается неизменным, даже если вещество переходит в другое состояние (как, например, происходит с водой – об этом речь пойдет позже).
Молекулярная структура вещества определяется формулой, дающей информацию об атомах и их количестве. Кроме того, молекулы, из которых состоит вещество/тело, не статичны: они сами подвижны – атомы вращаются, взаимодействуют друг с другом (притягиваются/отталкиваются).
Характеристики воды, её состояния
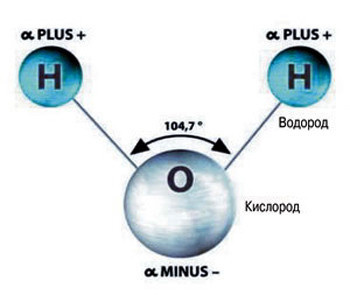
Состав такого вещества, как вода (а также ее химическая формула) известен каждому. Каждая ее молекула состоит из трех атомов: атома кислорода, обозначаемого буквой «О», и атомов водорода — латинской «Н», в количестве 2. Форма молекулы воды несимметрична (похожа на равнобедренный треугольник).
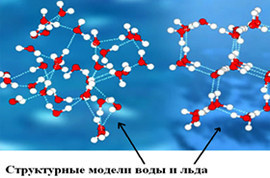
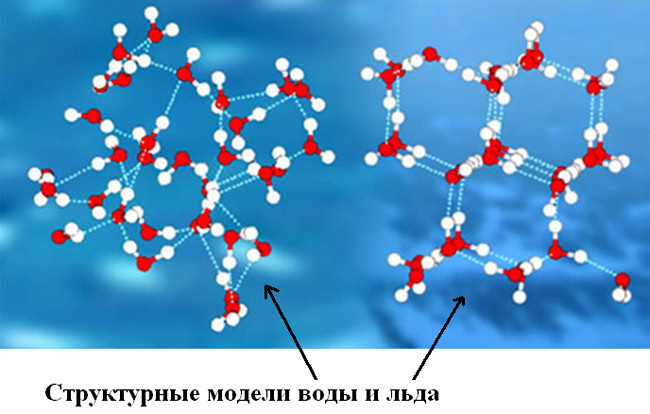
Молекула воды
Вода, как вещество, ее молекулы, реагирует на внешнюю «обстановку», показатели окружающей среды – температуру, давление. В зависимости от последнего вода может менять свое состояние, которых существует три:
- Наиболее распространенное естественное состояние воды – жидкое. Молекулярная структура (дигидроль) особого порядка, в которой отдельные молекулы заполняют (за счет водородных связей) полости.
- Состояние пара, при котором молекулярная структура (гидроль) представлена одиночными молекулами, между которыми не образуются водородные связи.
- Твердое состояние (сам лед) имеет молекулярную структуру (тригидроль) с прочными и стабильными водородными связями.
Помимо этих различий, конечно, различны и способы «перехода» вещества из одного состояния (жидкости) в другое. Эти переходы не только преобразуют вещество, но и провоцируют передачу энергии (выделение/поглощение). Среди них есть прямые процессы — превращение жидкой воды в пар (испарение), в лед (замерзание) и обратные процессы — в жидкость из пара (конденсация), из льда (таяние). Состояния воды — пара и льда — также могут переходить друг в друга: сублимация — лед в пар, сублимация — обратный процесс.
Специфичность льда как состояния воды
Общеизвестно, что лед замерзает (превращается из воды), когда температура переходит границу нуля градусов. Хотя это понятное явление имеет свои нюансы. Например, состояние льда неоднозначно; его типы и модификации различны. Они различаются прежде всего условиями, при которых возникают – температурой, давлением. Таких модификаций существует целых пятнадцать.
Лед в разных его видах имеет разную молекулярную структуру (молекулы неотличимы от молекул воды). Природный и природный лед, в научной терминологии обозначаемый как лед Ih, представляет собой вещество, имеющее кристаллическую структуру. То есть каждая молекула с четырьмя окружающими ее «соседями» (расстояние между всеми ними одинаковое) создает геометрическую фигуру — тетраэдр. Другие фазы льда имеют более сложную структуру, например, высокоупорядоченную структуру тригонального, кубического или моноклинного льда.
Основные отличия льда от воды на молекулярном уровне
Первое и не связанное напрямую с молекулярным строением воды и льда различие между ними – это показатель плотности вещества. Кристаллическая структура, присущая льду, по мере его формирования способствует одновременному снижению плотности (почти с 1000 кг/м³ до 916,7 кг/м³). А это стимулирует рост объёмов на 10%.
Основное различие молекулярного строения этих агрегатных состояний воды (жидкого и твердого) заключается в количестве, типе и прочности водородных связей между молекулами. Во льду (твердом состоянии) они объединяют пять молекул, а сами водородные связи более прочные.
Сами молекулы воды и ледяных веществ, как уже говорилось ранее, одинаковы. Но в молекулах льда атом кислорода (для создания кристаллической «решетки» вещества) образует водородные связи (две) с «соседними» молекулами».
Что отличает водное вещество в разных его состояниях (агрегатах), так это не только структура расположения молекул (молекулярная структура), но и их движение, сила сцепления/притяжения между ними. Молекулы воды в жидком состоянии притягиваются довольно слабо, что обеспечивает течение воды. В твердом льду притяжение молекул наиболее сильное, поэтому их двигательная активность невелика (это обеспечивает постоянство формы льда).