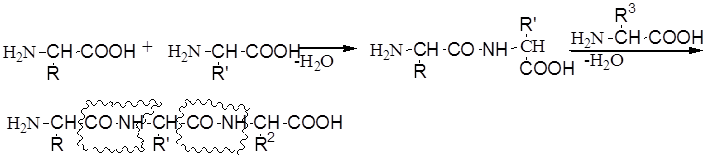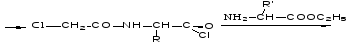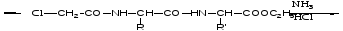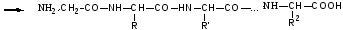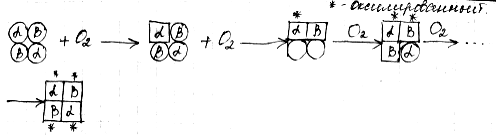Четвертичная структура белков



Четвертичная структура характерна для белков, построенных из двух или более пептидных цепей. Белки такого типа называются олигомерами или олигомерными белками. Отдельные структурные единицы олигомерного белка называют субъединицами или протмерами.
Субъединица (протомер) полипептидная цепь, характеризующаяся наличием третичной структуры.
Взаимное расположение субъединиц, т.е. способ их совместной укладки и упаковки с образованием нативной конформации олигомерного белка и называют четвертичной структурой.
Субъединицы связаны друг с другом посредством лишь слабых нековалентных взаимодействий (электро-статических, водородных, гидрофобных). Причем субъединицы взаимодействуют друг с другом только определенными участками своей поверхности (контактные участки).
Взаимное «узнавание» контактных участков происходит по принципу комплементарности. Каждая субъединица взаимодействует с другими во многих точках. Следовательно, ошибочные комплексы в олигомере практически невозможны.
Олигомерный белок может содержать две, три, четыре или более субъединиц. Иногда встречаются олигомеры, состоящие из 12 субъединиц и имеющие молекулярную массу до 1 000 000 килодальтон. Субъединицы могут быть одинаковыми или разными.
Взаимное расположение субъединиц, т.е. способ их совместной укладки и упаковки с образованием нативной конформации олигомерного белка и называют четвертичной структурой.
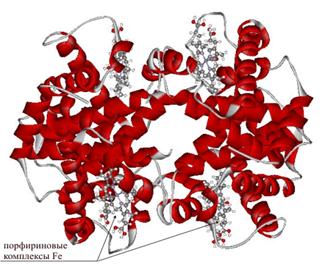
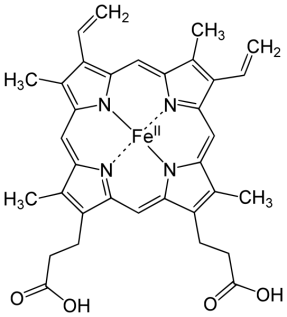
Наиболее изученным олигомерным белком является человеческий гемоглобин, который состоит из четырех субъединиц, двух α- (по 141 остатку в каждой) и двух β-субъединиц. (по 146 остатков в каждой). Субъединицы уложены приблизительно в виде тетраэдра, с каждой субъединицей связана одна молекула гема (Рис. 2.12):
Рис. 2.12. Строение молекулы гемоглобина: его субъединиц и структура гема (порфиринового комплекса Fe)
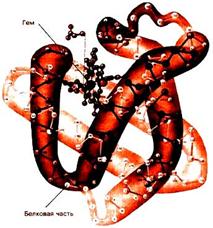
Третичная структура каждой субъединицы гемоглобина имеет много общего с третичной структурой миоглобина (Рис. 2.13):
Рис. 2.13. Строение молекулы миоглобина
Такое сходство связано с тем, что обе молекулы выполняют сходную функцию: связывание и транспорт кислорода. Модель молекулы гемоглобина.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями: 


Источник
1.Полипептидная теория белков
Согласно пептидной теории основой структуры белковой молекулы признана полипептидная цепь. Эта цепь построена из нескольких десятков, а иногда и сотен остатков аминокислот, связанных между собой пептидными связями.
Доказательства. Синтез полипептидов.
Белки – высокомолекулярные азотосодержащие вещества, находящиеся в клетках, преимущественно в коллоидном состоянии, то есть в состоянии, характеризующиеся крайней неустойчивостью, состав которых зависит от свойств среды.
Mrбелков зависит от количества аминокислот в молекуле.
Белки – мономолекулярные соединения.
Цитохром С – 104 аминокислотных остатка, Mrпостоянна.
Белки, содержащие несколько полипептидных цепей – олигомерны.
Связывание аминокислот между собой
Первое предположение о строении белков 1888 г Данилевским с щелочными растворами CuSO4все белки дают сине-фиолетовое окрашивание. Аналогичную реакцию дают пептоны – продукт расщепления белков протолитическими ферментами, подобное дает биурет: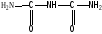
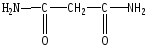
В белках амидная связь, которая образуется за счет взаимодействия карбоксильной по 1-ой аминокислоты и аминогруппы другой аминокислоты
а сами белки – полипептиды
Все усилия сводятся: защита аминогруппы и активация карбоксильной группы, чтобы реагировало то, что нужно:
Это синтез полипептида по Фишеру
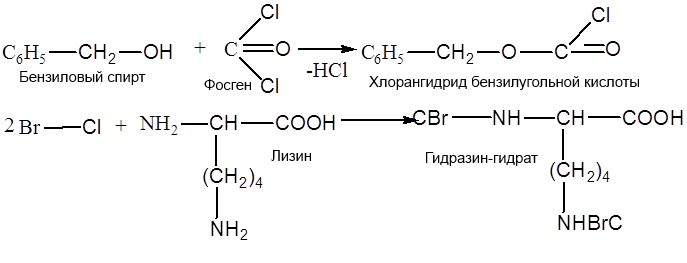
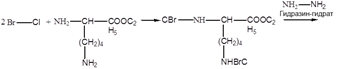
2. Метод Бергмана, Зиверса, Курциуса.
Защита по Зервесу: для защиты аминогрупп используются бензиловый эфир Cl – угольной кислоты.
надо снять защиту с 1-ой аминокислоты.
Граница между полипептидами и белками проведена условно. К белкам относят полипептиды с молекулярной массой 6 тысяч и более и числом аминокислотных остатков свыше 50. Такой принцип деления основан на способности к диализу через природные мембраны.
Белковая молекула может состоять из одной или нескольких полипептидных цепей. Цепи могут быть соединены между собой ковалентными или не ковалентными связями. Белки, состоящие из двух или нескольких полипептидных цепей, не связанных между собой ковалентными связями, называют олигомерным и. Отдельные полипептидные цепи в таких белках называют протомерами; функционально активные части белка — субъединицами.
2Гемоглобин
ГЕМОГЛОБИН — осн. белок дыхат. цикла, участвующий в переносе О2 от органов дыхания к тканям, а в обратном направлении — СО2. Содержится в эритроцитах. В организме человека 5-6 л крови, где ½
1/3 эритроциты, во взвешенном состоянии в плазме крови, которая ежедневно переносит
Образуется из ретикулоцитов.
Гемоглобин – сложный белок. Белковая часть – глобин, небелковая часть – гемм.
Глобин состоит из 4-х попарно одинаковых полипептидных цепей (α-2, β-2). Одна цепь из 146β аминокислотных остатков, другая из 141α.
Гемм– ароматическая плоская структура, содержащаяFe, который связан 6 координационными связями с одной стороны с глобином, с другой с атомами азота пирральных колец гемма, 1-с атомом азота гистидина, 1 – с молекулой кислорода.
• Оксигемоглобин = гемоглобин + О2. Координационная связь с кислородом, валентность железа не меняется (II). Неустойчив. Эта связь образуется в результате повышения парциального давления кислорода в легких. При этом меняется трепичная структура глобина. Он становится удобным для удержания
Гемоглобин– переносчик протонов и углекислого газа. На связываниеO2 с гемоглобином влияет рН среды и концентрацияCO2. Присоединение СО2и Н + кHbснижает его способность связыватьO2. В периферических тканях с понижением рН и повышением концентрации СО2, сродствоHbк О2падает по мере связывания СО2и протонов. В легочных капиллярах выделяется СО2и повышается рН среды в крови, следовательно повышается сродствоHbк О2(эффект Бора).
Протоны присоединяются к радикалам гистидина в 146 положении β-цепи и к другим гистидинам в α-цепи. СО2присоединяется к кольцевой α-аминогруппе каждой полипептидной цепи.Hbможет связывать малые молекулыCNиCO. С оксидом углерода (II) связывается легче чем с кислородом и образуется карбоксигемоглобин. При действии некоторых отравляющих окислителей ( переводомFe 2+ →Fe 3+ ) происходит окислениеHbв метгемоглобин. Цвет крови изменяется в коричневый, он не переноситO2, при его повышении наблюдается одышка, легкая утомляемость, резкая головная боль, рвота, потеря сознания, увеличивается печень, серо-синяя окраска слизистых и кожи. Окислители: нитросоед., орг. нитросоед., аминосоед. (анилин, аминофенолы, аминогидрозин и их производные: вакса, краски), хлораты, нафталин, феноны. Окислительно-восстановительные краски: метиленовый, синий.
Лечение.Введение антидотов – восстановителей: глюкоза, сульгидрильные соед. (β – меркаптоэтилаланин, кислородная компрессия (кислородная подушка)).
Это может быть наследственным заболеванием. Происходит если в одной из α цепей глобина в 58 положении вместо гистидина тирозин. Тирозин способствует образованию ковалентной связи вместо координатной и фиксируется степень окисления Fe 3+
150 видов мутантных гемоглобинов. Аномалия встречается у 1 из 10000 человек.
Серповидноклеточная анемия. Это наследственное заболевание, под влиянием физических нагрузок возникает одышка, таксикардия, .. в сердце. Содержание Hbв крови уменьшается. Возникают попутные заболевания (почки, сердце, печень). Эритроциты в форме серпов. Они становятся ломкими и быстро выходят из строя, забивают капилляры. Передается детям. Если болеет лишь 1 из родителей, ребенок – носитель (1%), а если гомозиготные, то 50 % эритроцитов. У африканцев 20 % — носители.
Эндемическое заболевания африканцев – малярия, удобные для вируса лишь круглые => основное население вымерло. 8 % негритянского населения – носители гена. В β – цепи в 6 положение вместо глутаминовой кислоты (полярная группа) находится валин (неполярная группа). Валин – липкий участок, к которому присоединяются другие липкие участки → деформирование эритроцитов.
Источник