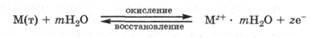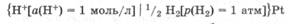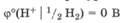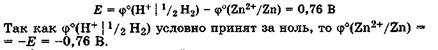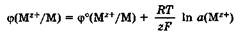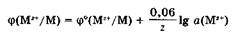Электродный потенциал. Стандартный водородный электрод. Гальванические цепи. Уравнение Нернста
Электродный потенциал возникает на границе соприкосновения металла с жидкостью, например с водой или водным раствором соли этого металла. Условное обозначение такой системы М z + /М, где М z + — потенциалопределяющие катионы металла (окисленная форма), черта отмечает наличие границы раздела раствор — твердая фаза, М — металл (восстановленная форма).
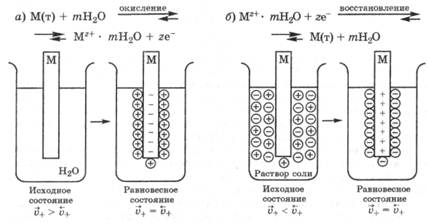
Рассмотрим процессы, протекающие при погружении металла в воду. Между катионами металлической решетки на поверхности металла и диполями воды возникают силы электростатического ион-дипольного взаимодействия. Те катионы, кинетическая энергия теплового движения которых достаточно велика, вследствие гидратации отрываются от поверхности металла и переходят в воду (реакция окисления). При этом металл заряжается отрицательно за счет избытка оставшихся электронов, а вода — положительно за счет перешедших в нее катионов металла. Разумеется, процесс перехода катионов в воду сопровождается и обратным процессом — переходом дегидратированных катионов металла из полученного водного раствора на поверхность металла (реакция восстановления). В целом этот окислительно-восстановительный процесс может быть выражен уравнением:
При погружении металла в чистую воду в начальный момент времени скорость выхода катионов 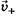
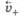
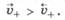
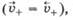
Если металл погрузить не в чистую воду, а в водный раствор его соли, то в зависимости от природы металла и концентрации (активности) его ионов в растворе возможно, что в начале скорость перехода катионов металла в раствор будет меньше, чем скорость их осаждения на поверхности металла, т. е. 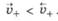
Следовательно, в результате перехода катионов металла через поверхность раздела металл — раствор всегда образуется ДЭС и возникает электродный потенциал. Величина электродного потенциала ф(М z + /М), возникающего на границе металл -раствор, зависит от следующих факторов:
— природы металла (энергии его кристаллической решетки, энергии ионизации атомов металла и энергии гидратации его катионов);
— активности (эффективной концентрации) потенциалопределяющих ионов в растворе;
Потенциал, возникающий в системе при стандартных условиях, называется стандартным и обозначается ф°(М z + /М).
Стандартным электродным потенциалом называется потенциал, возникающий на границе металл — раствор при активности потенциалопределяющих ионов в растворе 1 моль/л и температуре 298 К.
Рис. 25.1. Возникновение электродных потенциалов:
а — при погружении металла в чистую воду; б — при погружении металла в раствор его соли
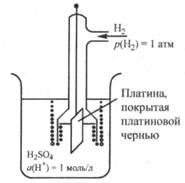 |
Рис. 25.2. Стандартный водородный электрод
Абсолютное значение стандартного электродного потенциала отдельно взятого электрода измерить или рассчитать невозможно, но можно определить его значение относительно какого-либо электрода, выбранного в качестве эталона. Согласно Международному соглашению таким эталоном служит стандартный водородный электрод.
В электрохимии используется шкала стандартных потенциалов, определенных относительно потенциала стандартного водородного электрода, значение которого условно принято равным нулю.
Стандартный водородный электрод представляет собой платиновую пластинку, покрытую платиновой чернью (рыхлой платиной) и опущенную в раствор кислоты, в котором активность ионов водорода равна 1 моль/л и через который все время пропускается очень чистый газообразный водород под давлением 1 атм (101 325 Па) (рис. 25.2).
Условное обозначение стандартного водородного электрода:
На водородном электроде протекают обратимые процессы:
Потенциал стандартного водородного электрода условно принят за нуль при любой температуре:
Следует отметить, что водородный электрод не очень удобен в работе, но важен в термодинамическом отношении, поскольку он служит первичным стандартом, относительно которого определяются потенциалы других электродов. На практике вместо водородного электрода в качестве электрода сравнения широко используют хлорсеребряный электрод, устройство и работа которого будут рассмотрены в разд. 25.6.
Для определения электродного потенциала какого-либо электрода относительно стандартного водородного составляют гальваническую цепь (элемент) из двух полуэлементов: исследуемого электрода и стандартного водородного электрода.
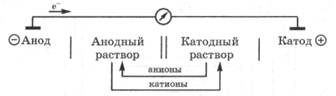
Гальваническая цепь представляет собой замкнутую систему, состоящую из двух электродов, соединенных между собой внешней цепью — электронный проводник (металл) и внутренней цепью — ионный проводник (растворы электролита, соединенные солевым мостиком). В гальванической цепи происходит превращение химической энергии процессов окисления и восстановления в электрическую энергию. В гальванической цепи различают электроды: анод и катод.
Анодом в электрохимии называется электрод, на котором протекает реакция окисления, т. е. отдача электронов.
В гальванической цепи анод заряжен отрицательно, и он посылает электроны во внешнюю цепь. Анодом всегда является электрод, материал которого легче окисляется, например более активный металл. В отличие от анода, анодный раствор из-за накопления в нем избытка катионов заряжается положительно.
Катодом в электрохимии называется электрод, на котором протекает реакция восстановления, т. е. присоединение электронов.
В гальванической цепи катод заряжен положительно, и он получает электроны из внешней цепи. Катодом является электрод из менее активного металла, катионы которого легче восстанавливаются. В отличие от катода, катодный раствор в гальванической цепи заряжается отрицательно из-за накопления в нем анионов.
Необходимо всегда помнить, что при рассмотрении электролиза (когда электрическая энергия превращается в химическую) характер процессов, протекающих на электродах, сохраняется, а знаки анода и катода изменяются на противоположные.
При условном обозначении гальванической цепи анод записывается слева, катод справа. Граница раздела между электродом и раствором, в который он опущен, обозначается одной чертой, а электролитический мостик, соединяющий анодный и катодный растворы, обозначается двумя чертами:
При замыкании гальванической цепи в ней из-за пространственного разделения реакций окисления (анод) и восстановления (катод) происходит направленное движение электронов от анода к катоду по внешней цепи, а ионов — по внутренней цепи (электролитическому мостику). Вследствие возникновения направленного движения заряженных частиц в гальванической цепи имеет место превращение химической энергии окислительно-восстановительных реакций в электрическую. Таким образом, гальванические цепи могут быть химическими источниками тока.
Способность гальванической цепи к переносу электрических зарядов характеризуется электродвижущей силой (ЭДС).
ЭДС гальванической цепи определяется как разность потенциалов катода и анода: Е = фк — фа.
В гальванической цепи, работающей самопроизвольно, потенциал анода всегда меньше потенциала катода, и ее ЭДС — величина положительная (Е > 0).
Измерение электродных потенциалов. Если измерить ЭДС гальванической цепи, составленной из исследуемого электрода и стандартного водородного, то можно определить значение электродного потенциала исследуемого электрода.
Значение электродного потенциала численно равно ЭДС гальванической цепи, составленной из стандартного водородного электрода и электрода, потенциал которого подлежит определению и имеет знак «+», если на нем протекает процесс восстановления, и знак «-«, если процесс окисления.
Рассмотрим конкретные примеры. Определим значение стандартного потенциала цинкового электрода, опущенного в раствор соли цинка, в котором активность катионов a(Zn 2+ ) = 1 моль/л. Поскольку цинк окисляется легче, чем водород, то в гальванической цепи цинковый электрод будет анодом, а стандартный водородный электрод — катодом (рис. 25.3).
Запишем схему составленной гальванической цепи:
Рис. 25.3. Гальваническая цепь для измерения стандартного электродного потенциала цинкового электрода
ЭДС этой гальванической цепи равна разности потенциалов катода и анода:
Определим стандартный потенциал медного электрода, если ЭДС гальванической цепи, составленной из определяемого электрода и стандартного водородного, равна 0,34 В.
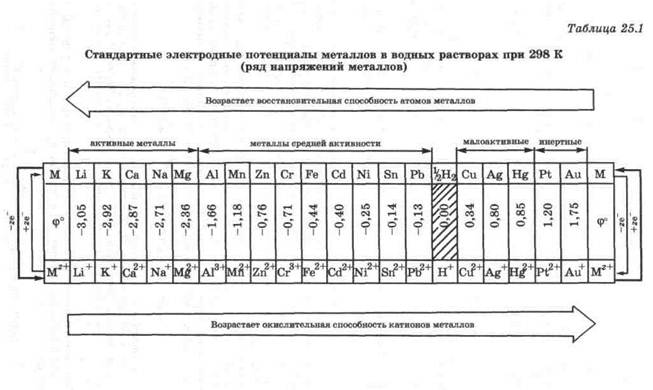
Величина стандартного электродного потенциала металла характеризует его способность отдавать электроны и имеет постоянное для каждого металла значение. Стандартные электродные потенциалы металлов приведены в табл. 25.1.
Ряд напряжений — это расположение металлов в порядке возрастания их стандартных электродных потенциалов.
В ряду напряжений те металлы, которые отдают электроны легче, чем водород, стоят слева от водорода и имеют отрицательные значения стандартных электродных потенциалов. Те металлы, которые отдают электроны труднее, чем водород, стоят справа от водорода и имеют положительные значения стандартных электродных потенциалов. Чем меньше значение ф°(М z + /М), тем активнее металл.
Уравнение Нернста. Значение электродного потенциала, возникающего на границе металл — раствор, зависит от природы металла, активности его ионов в растворе и от температуры. Влияние всех перечисленных факторов на величину электродного потенциала металла выражается уравнением Нернста:
где ф° — стандартный электродный потенциал; R — универсальная газовая постоянная, 8,31 Дж/(моль • К); Т — температура, К; г — заряд потен-циалопределяющих ионов металла; F — число Фарадея, 96 500 Кл/моль; а(М z + ) — активность потенциалопределяющих ионов металла в растворе, моль/л.
Если ввести численные значения постоянных R и F и перейти от натурального логарифма к десятичному, уравнение Нернста примет вид:
 |
При стандартной температуре 298 К уравнение Нернста имеет вид:
Зависимость электродного потенциала металла от концентрации его катионов в растворе лежит в основе применения концентрационных гальванических цепей.
Концентрационные гальванические цепи. В этих цепях материал электродов одинаковый, но они опущены в растворы с различной концентрацией потенциалопределяющих ионов. В концентрационных гальванических цепях анодом будет тот электрод, который опущен в раствор с меньшей концентрацией соли, а катодом — электрод, опущенный в раствор с большей концентрацией соли. ЭДС концентрационной гальванической цепи равна:
Концентрационные гальванические цепи широко используются для определения эффективной концентрации (активности) ионов в растворах, а также растворимости малорастворимых электролитов.
Воспользуйтесь поиском по сайту:

Источник