Вода является источником жизни для всех живых организмов.
Молекула воды имеет уникальную структуру. Он невероятным образом сочетает в себе прочность и устойчивость кристаллической структуры (льда) и подвижность жидкого вещества.
В статье мы подробно рассмотрим структурные свойства молекулы воды в разных агрегатных состояниях: жидком, твердом, газообразном.
Какое строение имеет молекула воды
Долгое время химики считали воду простым соединением, не вступающим в сложные реакции.
Состав воды как сложного вещества был установлен Лавуазье в 1783 году.
Молекула воды состоит из трех атомов: двух атомов водорода и одного атома кислорода, которые соединены ковалентной связью. Химическая формула: H2O
Характерными свойствами ковалентной связи являются направленность, насыщенность, полярность и поляризуемость. Они определяют химические и физические свойства соединений.
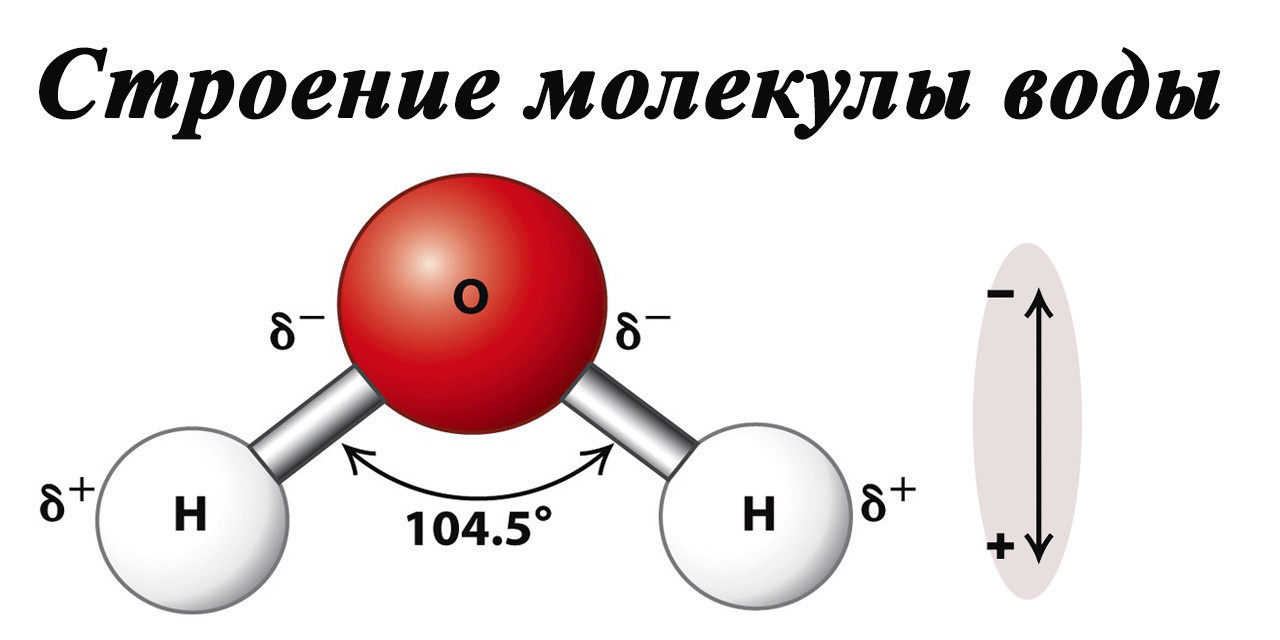
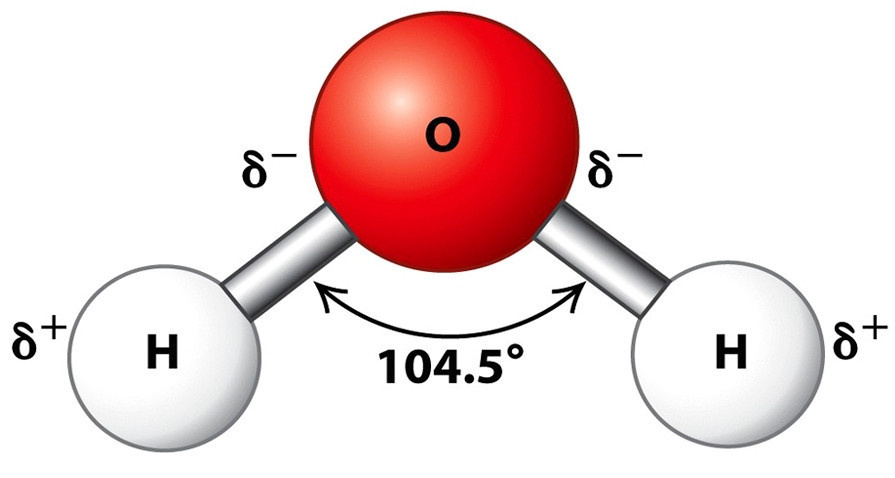
Форма молекулы воды напоминает равнобедренный треугольник, в нижней части которого находятся два атома водорода. Связь между атомом кислорода и атомами водорода полярная, поскольку кислород сильнее притягивает электроны, чем водород.
Межъядерные расстояния O–H близки к 0,1 нм, расстояние между ядрами атомов водорода – 0,15 нм, угол между связями H–O–H – 104,5°.
Молекула воды имеет два положительных и два отрицательных полюса и поэтому ведет себя в большинстве случаев как диполь (то есть с одной стороны имеется положительный заряд, а с другой — отрицательный)
Величина эффективных зарядов атомов составляет ±0,17 заряда электрона.
Водородная связь
В жидкой воде молекулы ассоциированы, то есть объединяются в более сложные агрегаты за счет особой химической связи, называемой водородной.
Особенностью водородной связи, благодаря которой она выделяется в отдельный вид, является ее не очень высокая прочность.
Водородная связь также играет важную роль в процессах растворения, поскольку растворимость также зависит от способности соединения образовывать водородные связи с растворителем. В результате вещества, содержащие ОН-группы, такие как сахар, глюкоза, спирты и карбоновые кислоты, обычно хорошо растворимы в воде.
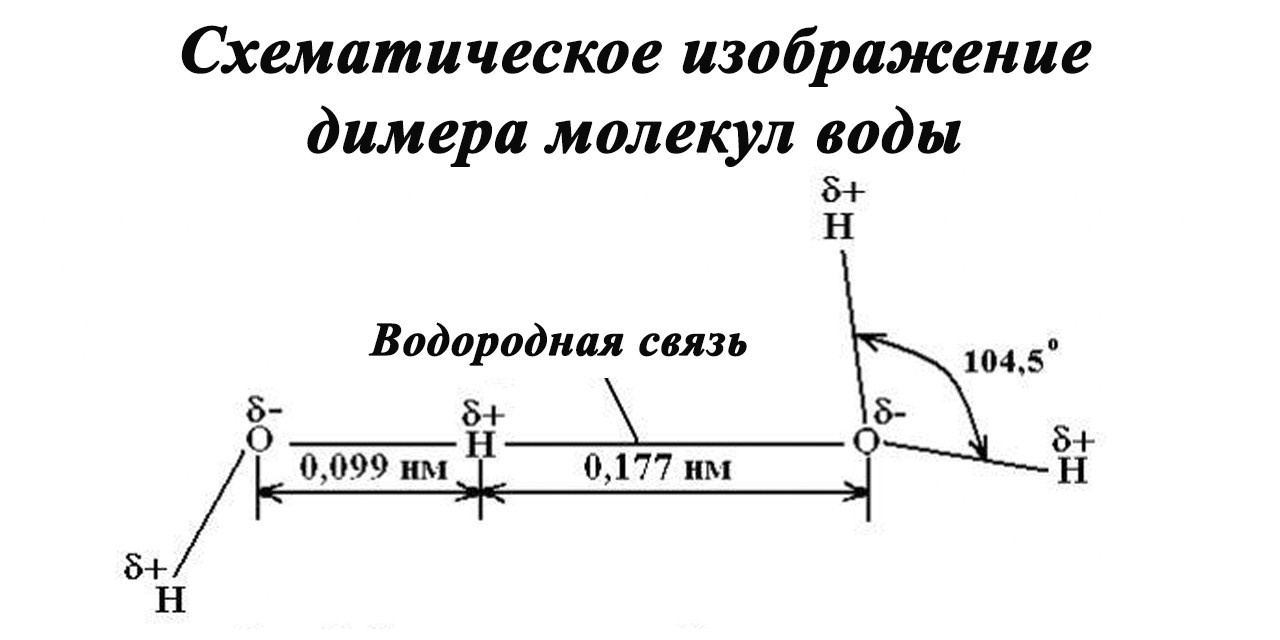
Димер – это две молекулы H2O, соединенные водородной связью. Связь между молекулами воды – водородная.
Каждая молекула способна образовывать четыре водородные связи: две между неподеленными электронными парами атома кислорода и атомами водорода соседних молекул и еще две между атомами водорода и атомами кислорода двух других молекул.
Энергия водородной связи может варьироваться от 17 до 33 кДж/моль.
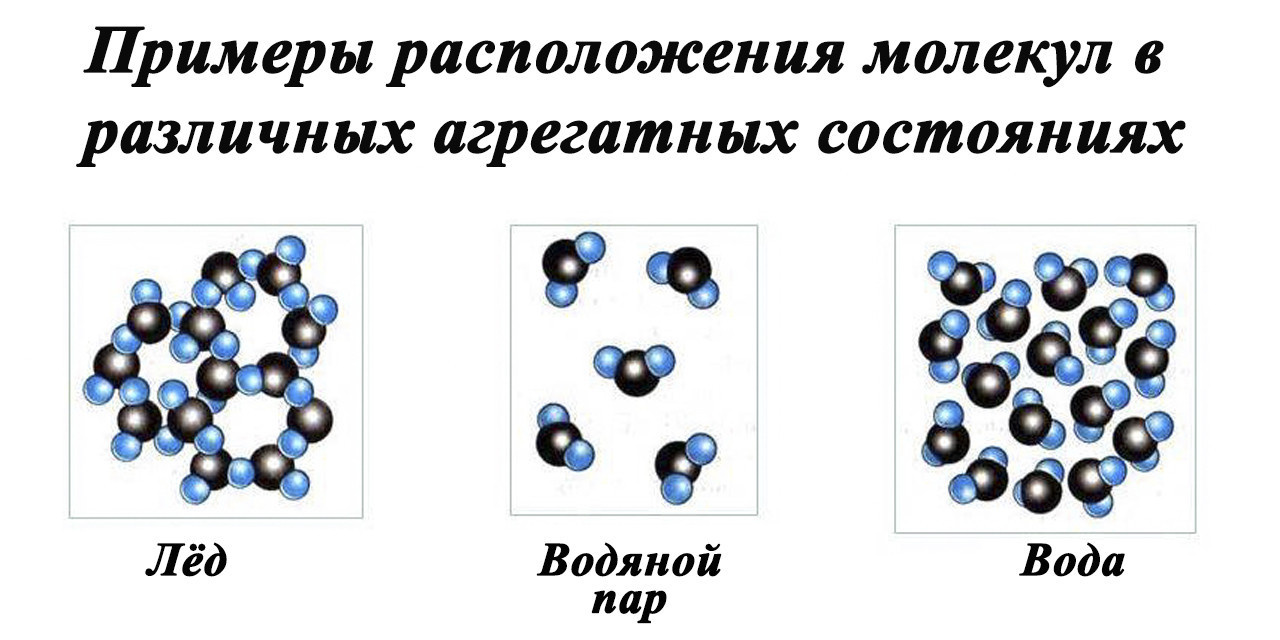
Строение молекулы в различных агрегатных состояниях
Вода может находиться в нескольких состояниях:
- Жидкость. Это его доминирующее состояние в нормальных условиях. Проточная вода образует множество рек, ручьев, озер и мирового океана.
- Твердое вещество — лед, а его кристаллы часто образуют иней или снег.
- Газообразный – водяной пар.
Существуют также переходные состояния жидкости, возникающие при замерзании или испарении.
Примечательно, что разные формы воды могут одновременно находиться рядом и даже взаимодействовать, например, реки с ледниками, айсберги с морской водой, облака на небе с водяным паром.
Строение молекулы воды, водородные связи способствуют расположению молекул воды. Рассмотрим функции каждого агрегатного состояния отдельно.
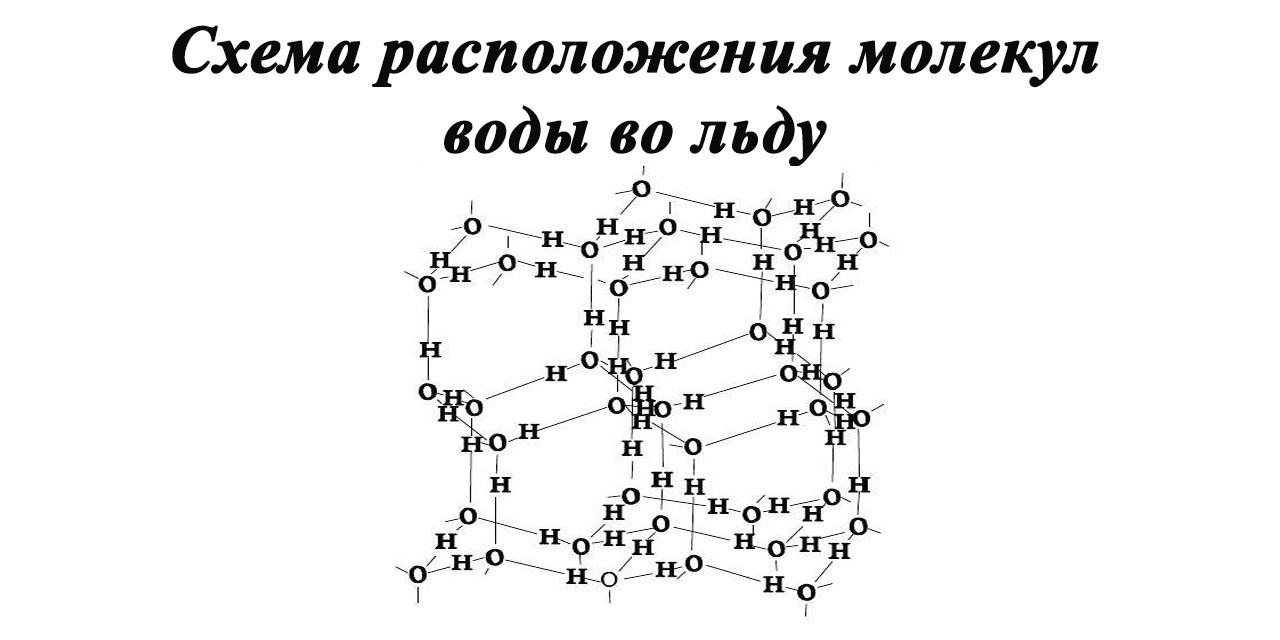
Лед
Представляет твердое состояние воды.
Молекулы воды образуют слои, при этом каждая молекула связана с тремя молекулами в своем слое и с одной молекулой в соседнем слое. Расстояние между атомами кислорода ближайших молекул составляет 0,276 нм.
Атом кислорода соединен с четырьмя атомами водорода: двумя, расположенными на расстоянии 0,096 – 0,102 нм посредством валентных связей, и двумя другими, расположенными на расстоянии 0,174 – 0,180 нм посредством водородных связей.
Жидкая вода
В отличие от структуры льда, структура жидкой воды еще недостаточно изучена.
Считается, что жидкая вода по своей структуре является промежуточным звеном между кристаллами льда и паром.
В результате изучения молекул воды с помощью инфракрасных и рентгеновских лучей стало ясно, что при температурах, близких к температуре замерзания, молекулы жидкой воды собираются в небольшие группы, почти как кристаллы.
При температуре, близкой к температуре кипения, они располагаются более свободно.
Водяной пар
Это газообразное агрегатное состояние воды.
В этом состоянии молекула воды не имеет структуры и состоит в основном из мономерных молекул воды, находящихся на расстоянии по отношению друг к другу.
Из чего состоит вода
В нормальных условиях вода выглядит как прозрачная жидкость. Он не имеет ни вкуса, ни запаха. При небольшой толщине слоя даже цвета не наблюдается.
Вода является отличным растворителем. В природе он постоянно содержит растворенные газы и соли. Когда атомы кислорода соединяются с водородом, образуется молекула воды. Поскольку соединения водорода более прочные, при разрушении они прикрепляются к другим веществам, помогая им раствориться.
Из-за своего небольшого размера каждое растворенное вещество окружено множеством молекул воды. Из-за этого он содержит отрицательные и положительные ионы.
Чистая вода также является хорошим изолятором с концентрацией протонов и гидроксильных ионов в количестве 10-7 моль/л, что позволяет ей проводить электричество. Именно по электропроводности можно судить о чистоте жидкости.
При взаимодействии с другими веществами состав воды не меняется, что играет особую роль в жизни любого живого организма. Ведь очень важно, чтобы жидкие растворы, через которые в организм поступают полезные вещества, не менялись.
Кроме того, вода хорошо поглощает инфракрасное и микроволновое излучение, а также способна хранить память о растворенных в ней веществах.
Элементы
В ходе гидрологического цикла: испарения, конденсации и осадков вода может пополняться различными химическими элементами, которые можно разделить на 6 категорий. Давайте посмотрим на информацию в Таблице №1.
Таблица №1 «Элементы, которые могут входить в воду».
| Ионы | Na, K, Mg, Ca, анионы: Cl, HCO3 и SO4. Эти компоненты содержатся в воде в наибольших количествах по сравнению с другими. |
| Растворенные газы | Кислород, азот, сероводород, углекислый газ и другие. Количество каждого газа в воде напрямую зависит от температуры. |
| Питательные вещества | Наиболее важными являются фосфор и азот, которые поступают в жидкость с осадками |
| Микроэлементы | Их около 30 видов: бром, селен, медь, цинк и др. их показатели в составе воды очень малы и колеблются от 0,1 до микрограмм на 1 литр. |
| Органический материал | Спирты, углеводы, альдегиды, фенолы, пептиды и т д. |
| Токсические вещества | Тяжелые металлы и нефтепродукты. |
Сейчас доступны специальные методы очистки, которые эффективно борются с вредными химическими соединениями.
Вода также может содержать катионы магния и кальция. В зависимости от этого его разделяют на мягкий и твердый.
Исходя из изотопов водорода в молекуле воды, можно говорить о легкой воде, тяжелой и сверхтяжелой воде.
Подводим итоги
Вода необходима для жизни всего живого на Земле. Он участвует в глобальном круговороте воды в природе. За счет испарения с поверхности водоемов, почвы и растений образуются облака. Затем они выпадают в виде дождя, снега, града, питают подземные воды и родники. Родниковая вода течет через реки и попадает в море.
Таким образом, количество воды на Земле не меняется, она меняет лишь свои формы – таков круговорот воды в природе.
Уникальная структура молекулы воды помогает ей переходить в три агрегатных состояния.
Когда вода замерзает, молекулы собираются в небольшие группы. При испарении они располагаются на расстоянии относительно друг друга. Жидкая вода по своей структуре представляет собой нечто среднее между кристаллами льда и паром.
Библиография
- Химия и микробиология воды. Учебник В.В. Котов, Г.А. Нетесова
- Конспект лекций ГИДРОГЕОХИМИЯ. Киреева Т.А., МГУ. М.В. Ломоносова, 2016 г