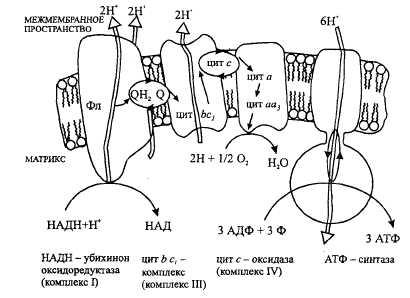
43. Дыхательная цепь в митохондриях
Система структурно и функционально связанных трансмембранных белков и переносчиков электронов. Она позволяет запасти энергию, выделяющуюся в ходе окисления NAD*H и ФАДН2 молекулярным кислородом в форме трансмембранного протонного потенциала за счёт последовательного переноса электрона по цепи,сопряжённого с перекачкой протонов через мембрану. Транспортная цепь у эукариот локализована на внутренней мембране митохондрий. В дыхат.цепи 4 мультиферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.
1.Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). 2.Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
1.Восстановление ФАД 3ий-цитохром с-оксидоредуктаза.
2.Принимает электроны от коэнзима Q и передает их на цитохром с.
3.Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
4ый-цитохром с-кислород оксидоредуктаза.
1.Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
2.Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Все атомы водорода, отщепленные дегидрогеназами от субстратов в аэробных условиях, достигают внутренней мембраны митохондрий в составе НАДН или ФАДН2.
Электроны по мере передвижения теряют энергию->энергия тратиться комплексами на перекачку протонов Н.Перенос ионов Н происходит в строго определённых участках->участках сопряжения.Результат: происходит наработка АТФ: ионы H+ теряют свою энергию, проходя через АТФ-синтазу.Часть этой энергии тратится на синтез АТФ. Другая часть рассеивается в виде тепла.
Дыхательная цепь митохондрий состоит из 5 мультифер-ментных комплексов, субъединицы которых кодируются как ядерными, так и митохондриальными генами. В переноске электронов участвуют коэнзим Q10 и цитохром с. Электроны поступают от молекул NAD*H и FAD’H и переносятся по дыхательной цепи. Высвобождаемая энергия используется для транспорта протонов к внешней мембране митохондрий, а возникающий электрохимический градиент — для синтеза АТФ с помощью комплекса V дыхательной цепи митохондрий
44. Последовательность и строение переносчиков электронов в дыхательной цепи
1 комплекс. НАДН-КоQ-оксидоредуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН (флавинмононуклеотид), 22 белковых молекулы, из них 5 железосерных белков с общей молекулярной массой до 900 кДа.
— Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
— Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
2 комплекс. ФАД-зависимые дегидрогеназы
Он включает в себя ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса НАДН в митохондрию).
— Восстановление ФАД в окислительно-восстановительных реакциях.
— Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q.
46. Биохимические механизмы разобщения окисления и фосфорилирования факторы их вызывающие Разобщение дыхания и фосфорилирования
Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители — липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ — 2,4-динитрофенол (рис. 6-17), легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс.
Примерами разобщителей могут быть также некоторые лекарства, например дикумарол — антикоагулянт (см. раздел 14) или метаболиты, которые образуются в организме, билирубин — продукт катаболизма тема (см. раздел 13), тироксин — гормон щитовидной железы (см. раздел 11). Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
Выключение фосфорилирования по исчерпании АДФ либо неорганического фосфата сопровождается торможением дыхания (эффект дыхательного контроля). Большое число повреждающих митохондриальную мембрану воздействий нарушает сопряжение между окислением и фосфорилированием, разрешая идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения)
Для синтеза 1 молекулы АТФ необходимо 3 протона.
2. Ингибиторы окислительного фосфорилирования:
Ингибиторы блокируют V комплекс:
Олигомицин — блокируют протонные каналы АТФ-синтазы.
Атрактилозид, циклофиллин — блокируют транслоказы.
3. Разобщители окислительного фосфорилирования:
Разобщители — липофильные вещества, которые способны принимать протоны и переносить их через внутреннюю мембрану митохондрий минуя V комплекс(его протонный канал). Разобщители:
Естественные — продукты перекисного окисления липидов, жирных кислот с длинной цепью; большие дозы тиреоидных гормонов.
Искусственные — динитрофенол, эфир, производные витамина К, анестетики.
Источник
64. Электрон-транспортная цепь митохондрий
Дыхательная цепь является частью процесса окислительного фосфорилирования (см. с. 126). Компоненты дыхательной цепи катализируют перенос электронов от НАДН + Н + или восстановленного убихинона (QH2) на молекулярный кислород. Из-за большой разности окислительно-восстановительных потенциалов донора (НАДН + Н + и, соответственно, QH2) и акцептора (О2) реакция является высокоэкзергонической (см. с. 24). Большая часть выделяющейся при этом энергии используется для создания градиента протонов (см. с. 128) и, наконец, для образования АТФ с помощью АТФ-синтазы.
А. Компоненты дыхательной цепи Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-переносчики — убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая собственно к цитратному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза (см. с. 144) иногда называется комплексом V, хотя она не принимает участия в переносе электронов.
Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различныхокислительно-восстановительных коферментов, связанных с белками (см. сс. 108, 144). К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена.
Электроны поступают в дыхательную цепь различными путями. При окислении НАДН + Н + комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин (см. с. 166), При этом окисленная форма кофермента Q восстанавливается в ароматическийубигидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем с1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (CuA и CuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2 образуется сильный основной анион О 2- , который связывает два протона и переходит а воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом.
Б. Организация дыхательной цепи Перенос протонов комплексами I, III и IV протекает векторно из матрикса в межмембранное пространство. При переносе электронов в дыхательной цепи повышается концентрация ионов H + , т. е. понижается значение рН. В интактных митохондриях по существу только АТФ-синтаза (см. с. 144) позволяет осуществить обратное движение протонов в матрикс. На этом основано важное в регуляторном отношении сопряжение электронного переноса с образованием АТФ (см. с. 146). Как уже упоминалось, все комплексы с I по V интегрированы во внутренней мембране митохондрий, тем не менее обычно они не контактируют друг с другом, так как электроны переносятся убихиноном и цитохромом с. Убихинон благодаря неполярной боковой цепи свободно перемещается в мембране. Водорастворимый цитохром с находится на внешней стороне внутренней мембраны.
Окисление НАДН (NADH) комплексом I происходит на внутренней стороне мембраны, а также в матриксе, где происходит также цитратный цикл и β-окисление — самые важные источники НАДН. В матриксе протекают, кроме того, восстановление O2 и образование АТФ (ATP). Полученный АТФ переносится по механизму антипорта (против АДФ) в межмембранное пространство (см. с. 214), откуда через порины проникает в цитоплазму.(Рязанова Маня)
Источник
4)Дыхательная цепь и комплексы с переносом заряда.
Цепь переноса электронов митохондрий
Цепь переноса электронов (дыхательная цепь) – это сложная система переносчиков, при участии которой происходит процесс последовательного переноса электронов от NADH и FADH2 на O2.
Дыхательной цепи предшествует отнятие атомов водорода от окисляемых субстратов (реакции дегидрирования).
Эти реакции относятся к окислительно-восстановительным.
Их катализируют ферменты оксидоредуктазы (подкласс: дегидрогеназы).
В основе функционирования ЦПЭ лежит работа 5 основных компонентов, обеспечивающих перенос электронов от NADH и FADH2 на O2.
В их число входит 3 сложных ферментных комплексов, а также 2 низкомолекулярных переносчика.
NADH-дегидрогеназа (комплекс I);
сукцинатдегидрогеназа (комплекс II);
низкомолекулярный переносчик: убихинон (кофермент Q);
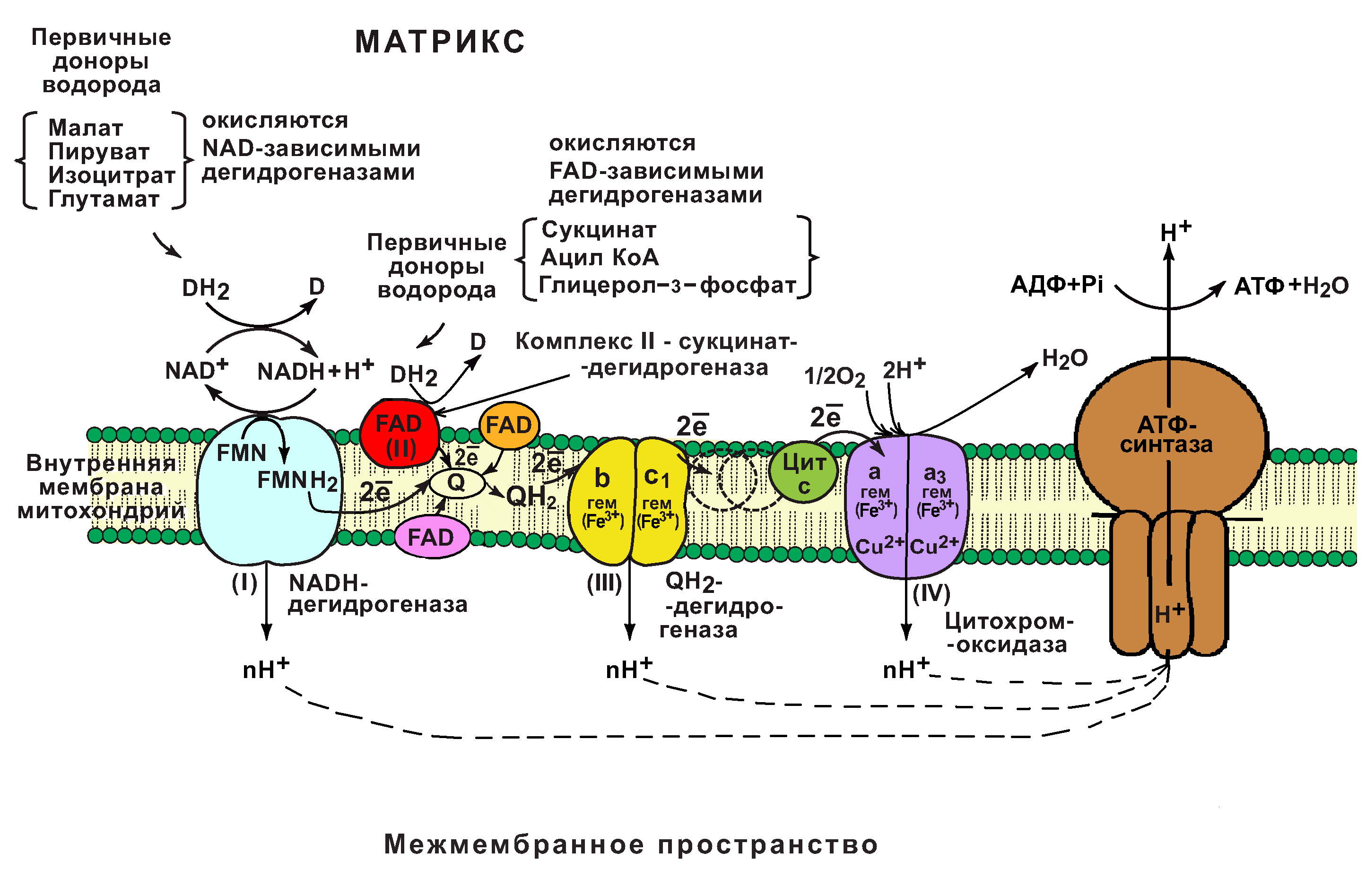
низкомолекулярный переносчик (цитохром с);
цитохромоксидаза (комплекс IV)
Все компоненты ЦПЭ располагаются во внутренней мембране митохондрий в порядке возрастания окислительно-восстановительных потенциалов (редокс-потенциалов).
Комплексы дыхательной цепи
Комплекс I (НАДН-дегидрогеназный комплекс) окисляет НАД-Н, отбирая у него два электрона и перенося их на растворимый в липидах убихинон, который внутри мембраны диффундирует к комплексу III. Вместе с этим, комплекс I перекачивает 2 протона и 2 электрона из матрикса в межмембранное пространство митохондрии.
Комплекс II (Сукцинатдегидрогеназа) не перекачивает протоны, но обеспечивает вход в цепь дополнительных электронов за счёт окисления сукцината.
Комплекс III (Цитохром-bc1-комплекс) переносит электроны с убихинона на два водорастворимых цитохрома с, расположенных на внутренней мембране митохондрии. Убихинон передаёт 2 электрона, а цитохромы за один цикл переносят по одному электрону. При этом туда также переходят 2 протона убихинона и перекачиваются комплексом.
Комплекс IV (Цитохром c оксидаза) катализирует перенос 4 электронов с 4 молекул цитохрома на O2 и перекачивает при этом 4 протона в межмембранное пространство. Комплекс состоит из цитохромов a и a3, которые, помимо гема, содержат ионы меди.
Кислород, поступающий в митохондрии из крови, связывается с атомом железа в гемецитохрома a3 в форме молекулы O2. Каждый из атомов кислорода присоединяет по два электрона и два протона и превращается в молекулу воды.
5)Структура и функции конкретных компонентов дыхательной цепи.
1) НАДН-дегидрогеназа(НАДН-КоQ-оксидоредуктаза) – встроена во внутреннюю мембрану митохондрий. Это флавин-зависимый фермент, в состав которого входит витамин В2. Сложный, имеет 2 простетические группы: ФМН (флавинмононуклеотид – активная форма витамина В2) и Железосерные белки (FеS-белки). АтомыFe, входящие в FеS-центры являются негеминовыми (не входят в состав гема). Активный центр НАДНДГ обращён в сторону матрикса митохондрий. НАДНДГ дегедрирует НАДН (отщепляет Н2) и передаёт протоны и электроны сначала на ФМН, а потом ч/з FеS-центры на СоQ(восстанавливается и превращается в КоQН2 или убихинол).
Функция: а)Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
б) Переносит 4 иона Н + на наружную поверхность внутренней митохондриальной мембраны.
2) КоQ (убихинон) – небелковый переносчик, находится в растворенном состоянии, т.к. является жирорастворимым (растворяется в липидном слое мембран). Поэтому может перемещаться как вдоль так и поперек мембраны (не заряжен). Поэтому он принимает электроны и протоны с ФАДН2, т.е. ч/з 2й вход в дыхательную цепь. Его называют коллектором электронов.
3) Цитохромы (b, c1, c, а, а3)– сложные белки (гемпротеины), небелковой частью которых является гем, содержащийFе 3+ (окисленная форма). Fегема может обратимо принимать и отдавать электроны.
4) УбихинолДГ (КоQ-цитохром с-оксидоредуктаза)– это ферментный комплекс, состоящий из цитохромовbи с1, включающий также FеS-центры. Функция:
а) Принимает электроны от коэнзима Q и передает их на цитохром с (при этом Fе восстанавливается до 2х валентного); б)Переносит 2 иона Н + на наружную поверхность внутренней митохондриальной мембраны.
5) Цитохром с-кислород-оксидоредуктаза — В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, всего содержит 6 полипептидных цепей. В комплексе также имеется 2 иона меди. Функция: а) Принимает электроны от цитохрома с и передает их на кислород с образованием воды. б)Переносит 4 иона Н + на наружную поверхность внутренней митохондриальной мембраны.
6) АТФ-синтаза– комплекс, состоящий из множества белковых цепей, подразделенных на две большие группы: одна группа формирует субъединицу Fо (произносится со звуком «о», а не «ноль» т.колигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс. Другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ.
Источник