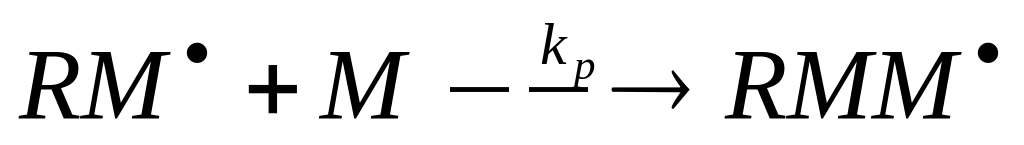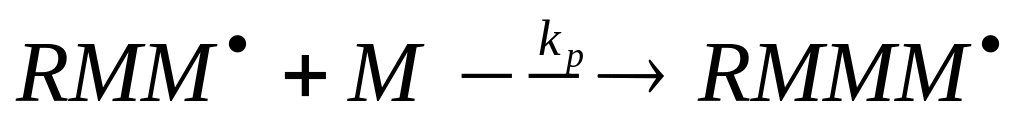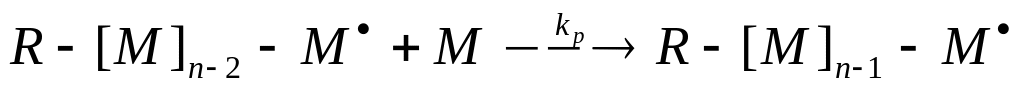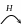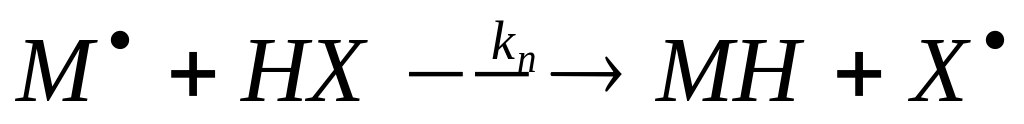6.2. Механизм цепных химических реакций
6.2.1. Зарождение цепей
Наиболее часто зарождение цепи происходит, когда в результате элементарной стадии образуются свободные радикалы, которые могут возникать в самой системе или могут быть занесены в нее.
Зарождение цепи может происходить следующим образом:
а) Свободные радикалы образуются из молекул в результате мономолекулярного распада под действием высоких температур.
б) Фотохимическое инициирование.
в) При облучении g-, b- или a- излучением возникают радикалы различных типов (в том числе анион-радикалы, катион-радикалы и.т.д.).
г) Гетерогенное зарождение цепей (например, при адсорбции со стенкой сосуда с разрывом связи).

д) Образование радикалов при химическом взаимодействии.
Например, парообразный натрий — одноатомный газ, где каждый атом натрия является радикалом. Если ввести пары натрия в смесь газообразного водорода и хлора, зарождается цепь.
е) Спонтанное (самопроизвольное) генерирование радикалов.
Например: в результате нескольких удачных соударений молекул брома происходит гомолитический разрыв связи.
В данном случае инициаторы – это соединения, которые легко распадаются с образованием свободных радикалов (перекиси, диазосоединения и др.) или некоторые химически активные газы, которые имеют неспаренный электрон (NO, NO2).
6.2.2. Продолжение цепей
Для неразветвленных цепей.
а) Радикал реагирует с молекулой исходного соединения с образованием нового свободного радикала. Например:
б) Радикал реагирует с молекулой исходного соединения с образованием нового свободного радикала и молекулы конечного
в) Мономолекулярное превращение одного радикала в другой.
г) Мономолекулярный распад радикала с образованием продукта реакции и нового свободного радикала.
В любом цепном процессе обязательно должна быть, как минимум, одна стадия, в которой расходуется вещество, и одна стадия, в которой образуются продукты реакции.
В разветвленных цепных реакциях просто добавляются стадии, которые для них характерны (стадии разветвления).
Обрыв цепей
Реакции обрыва цепей, скорость которых пропорциональна первой степени концентрации свободных радикалов называются реакциями линейного обрыва цепей.
а) Захват свободного радикала стенкой сосуда.
б) Взаимодействие свободных радикалов с соединениями
металлов переменной валентности.
в) Взаимодействие свободных радикалов с валентнонасыщенными молекулами с образованием малоактивного радикала.
· ООН – перекисный радикал, который малоактивен и исчезает по реакции: ·ООН + Н· + М Н2 + О2 + М*
г) Присутствие ингибиторов свободнорадикальных реакций.
Реакция обрыва цепей, скорость которых пропорциональна произведению концентраций двух радикалов или квадрату концентрации одного радикала, называется реакцией квадратичного обрыва цепей.
Эта реакция экзотермическая, поэтому если энергия, которая выделяется при рекомбинации радикалов, не будет снята хотя бы частично с образованием валентнонасыщенной молекулы, то последняя вновь распадется на радикалы.
Следовательно, реакция рекомбинации радикалов – тримолекулярная. Например:
где, М* — молекула в возбужденном состоянии.
Источник
3). Реакция обрыва цепи
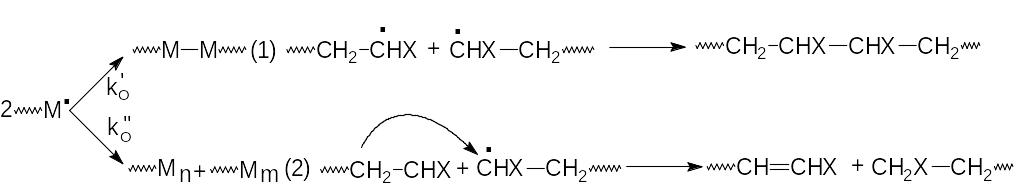
Реакция обрыва — это процесс, приводящий к насыщению свободной валентности и не сопровождающийся возникновением нового СР. В эависимости от активности, строения и длины макрорадикала, вязкости среды, температуры, состава реакционной смеси механизм обрыва может быть различным.
1) Растущие цепи могут рекомбинировать (1) или диспропорционировать(2):
ko и ko — константы скорости реакции обрыва путем рекомбинации и диспропорционирования, соответственно.
2) Растущие радикалы могут взаимодействовать с примесями или специальными добавками. Каждый из этих видов обрыва характеризуется своей константой скорости. Если примем, что в системе нет примесей, то обрыв происходит только в результате рекомбинации или диспропорционирования, относительная роль которых зависит от природы М и Т.
Определяют механизм обрыва по числу осколков меченного инициатора, вошедших в цепь: два — в случае рекомбинации (Ст при любых Т) и один — для диспропорционирования (ММА при 60C). Однако при этом надо учитывать, что два осколка инициатора могут входить в макроцепь и в случае явно выраженной рекции передачи цепи на инициатор.
Энергия активации реакции обрыва (Е a ) меньше 5 ккал/моль. Как правило, Е à (рек) = 0,5-1 ккал/моль, т.е. практически не зависит от температуры, а Е а (дис) = 4-5 ккал/моль и ее вероятность возрастает при повышении температуры.
С увеличением степени конверсии (или Рn) вязкость реакционной системы в отсутствие растворителя (например при полимеризации в блоке) возрастает, что препятствует свободному перемещению растущих макрорадикалов. В результате скорость эффективных соударений растущих макрорадикалов уменьшается, поэтому падает вероятность обрыва (ko). Благодаря этому падению Wo, резко возрастает время жизни макрорадикалов и, следовательно, ММ. Однако увеличение вязкости реакционной системы не оказывает влияния на скорость движения молекул мономера , т.е. kр, поэтому Wр не уменьшается. Вот почему общая скорость реакции (kр/kо) растет и наступает «автокатализ» или «гель-эффект».
Величина наблюдаемого самоускорения и глубина реакции, при которой оно наступает, колеблется в широких пределах и зависит от природы мономера, ММ полимера, Т и наличия растворителей.
После «гель-эффекта» Wпол резко уменьшается, т.к. в такой застывшей массе затрудняется уже и перемещение мономера, однако, если добавить растворитель, скорость полимеризации может снова возрасти.
Уменьшить влияние «гель- эффекта» (или вовсе устранить его) необходимо, особенно в производстве крупноблочных изделий, т.к. из-за плохого теплоотвода, вследствие низкой теплопроводности полимера, при сильном увеличении Wпол температура внутри блока сильно возрастает и мономер может закипеть , т.е. появятся пузырьки внутри образца и он станет мутным( ММА, температура кипения
Для устранения «гель-эффекта»:
1) используют методы повышения Wин, применяя высокоэффективные инициаторы.
2) снижают Wпол на стадии «гель-эффекта» путем, например, добавления системы RSH + алкилнитриты.
3) снижают тепловыделение на стадии » гель-эффекта» путем сополимеризации с соединениями, полимеризующимися с поглощением тепла, или добавления веществ, которые разлагаются с выделением веществ, ингибирующих полимеризацию.
Источник
Рост цепи
Рост цепи – основная стадия радикальной полимеризации, ответственная за образование макромолекулы. Она заключается в последовательном присоединении молекул мономера к активному центру, причем строение центра как свободнорадикальной частицы сохраняется.
В общем виде реакция роста цепи может быть представлена следующим образом:
Если принять допущение, что реакционная способность растущего радикала не зависит от его длины, то скорость роста цепи подчиняется выражению
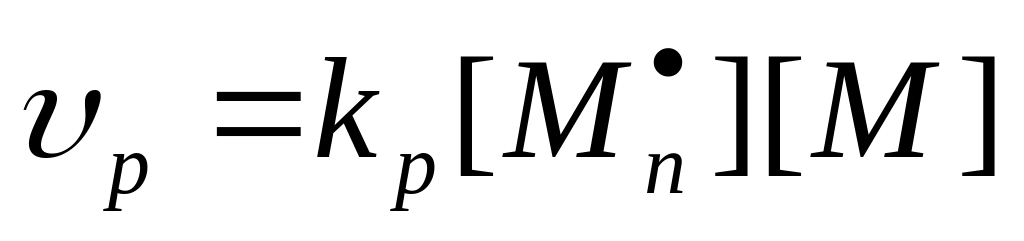
где 


Рост цепи – быстрая реакция,
10 4 л/мольс. Энергия активации низкая, 20-35 кДж/моль (это в несколько раз ниже энергии активации инициирования пероксидными инициаторами).
Для винильных мономеров возможны два способа присоединения радикала к двойной связи: к замещенному и к незамещенному атому углерода. В результате образуются полимеры, звенья в которых соединяются по типу «голова к хвосту» или «голова к голове» («хвост к хвосту»):
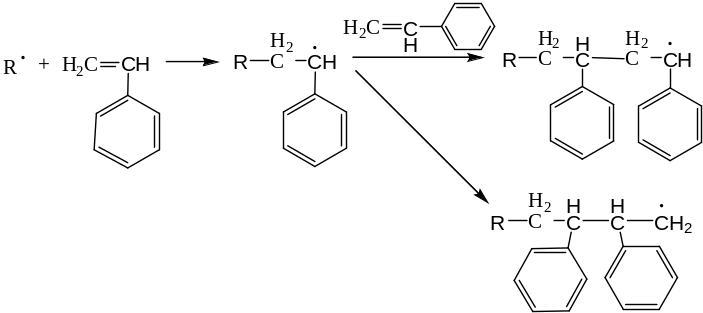
Обрыв цепи
Обрыв цепи – это реакция гибели активных центров. Истинный обрыв цепи приводит к обрыву материальной и кинетической цепи. Эта реакция может произойти на любой стадии полимеризации, что приводит к получению макромолекул различной длины.
Различают 2 способа обрыва цепи.
Рекомбинация – соединение растущих макрорадикалов друг с другом с образованием валентной связи. Реакция описывается схемой
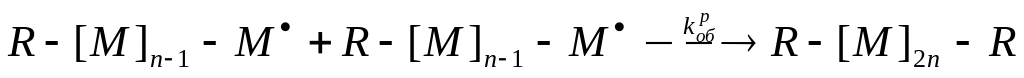
где 
Скорость реакции обрыва рекомбинацией описывается уравнением
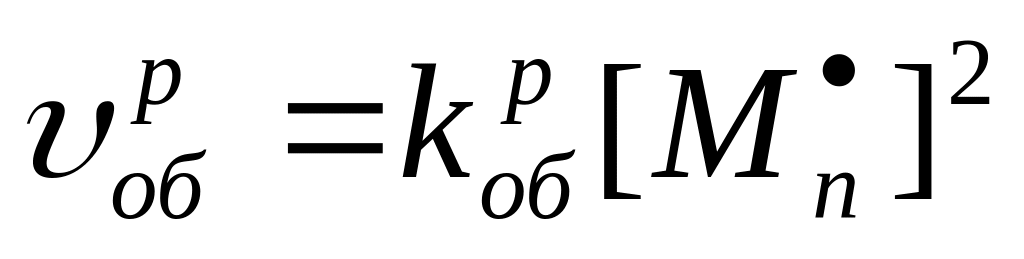
где 
Диспропорционирование – межмолекулярная перегруппировка посредством передачи атома водорода от одного макрорадикала к другому. В результате реакции образуются две макромолекулы, одна из которых имеет на конце двойную связь:
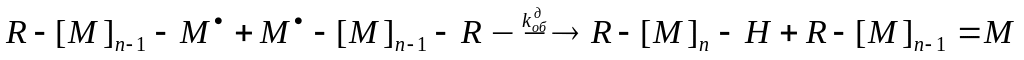
где 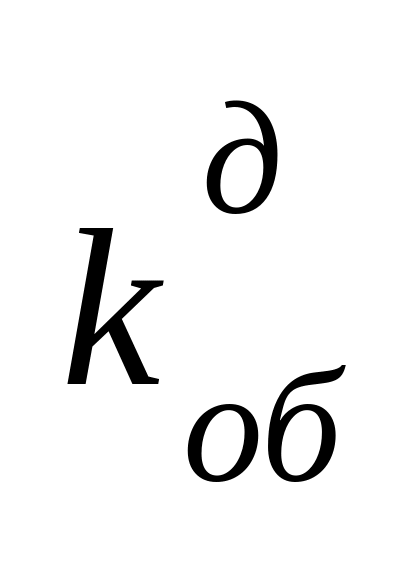
Скорость реакции обрыва диспропорционированием описывается уравнением
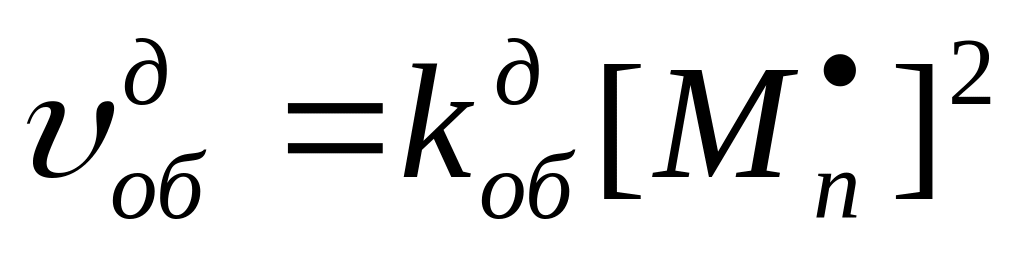
где – концентрация растущих макрорадикалов.
При полимеризации большинства мономеров возможен обрыв по обоим механизмам, причем чем выше реакционная способность растущего радикала, тем больше доля реакции обрыва диспропорционированием.
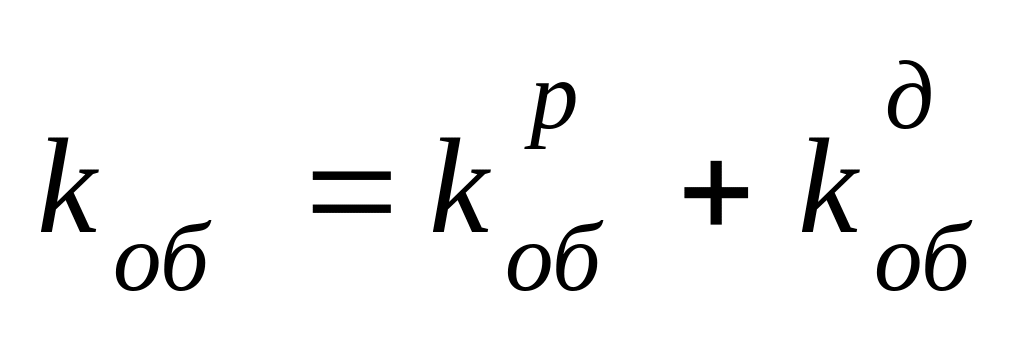
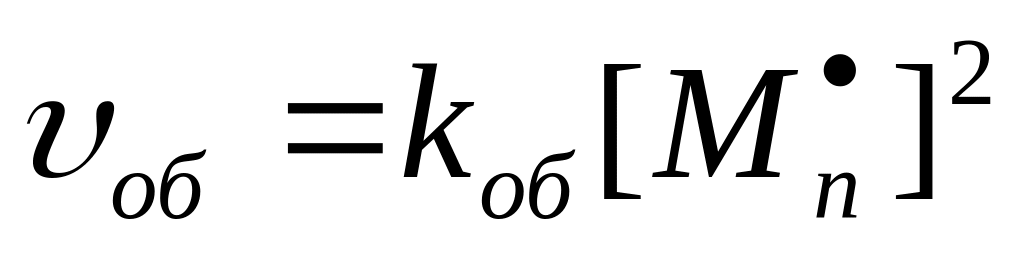
Уравнение характеризует скорость реакции обрыва цепи вследствие бимолекулярного обрыва.
Обрыв цепи протекает со скоростью, на несколько порядков более высокой, чем скорость роста цепи. Энергия активации обрыва цепи близка нулю.
Обрыв цепи часто сопровождается обрывом только материальной цепи при сохранении кинетической, т.е. с сохранением свободнорадикального центра. Такие реакции называются реакциями передачи цепи.
Передача кинетической цепи – бимолекулярная реакция, в которой участвуют макрорадикал и какой-либо из компонентов реакционной смеси. Ее можно отнести к реакциям замещения. Наиболее активны в передаче цепи вещества, содержащие подвижные атомы водорода или галогена. Обычно реакция передачи цепи сопровождается образованием неактивной («мертвой») макромолекулы и новой частицы, содержащей неспаренный электрон:
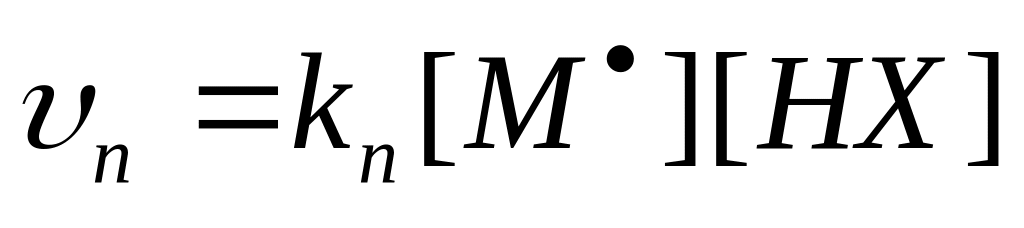
В зависимости от реакционной способности образующегося радикала 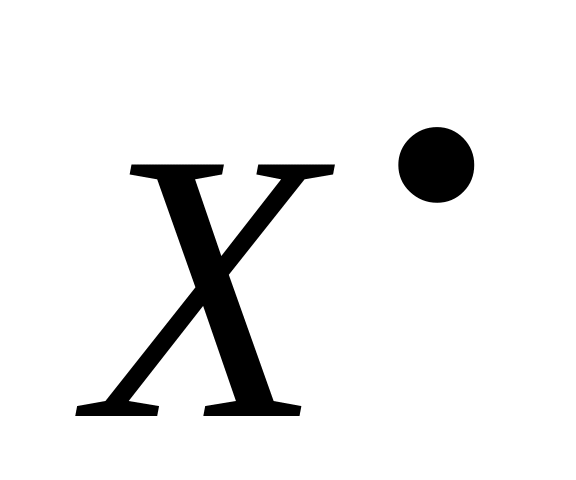
Различают следующие типы реакций передачи цепи:
Не приводящие к ингибированию – реакции передачи цепи на мономер, инициатор, полимер, растворитель.
Сопровождающиеся ингибированием – реакции, идущие в присутствии ингибиторов и замедлителей.
Все реакции передачи цепи, за исключением передачи цепи на полимер, приводят к уменьшению молекулярной массы полимера.
Реакции передачи цепи используются для получения теломеров и для получения полимеров с заданной молекулярной массой.
Передача цепи на мономер – это взаимодействие макрорадикала 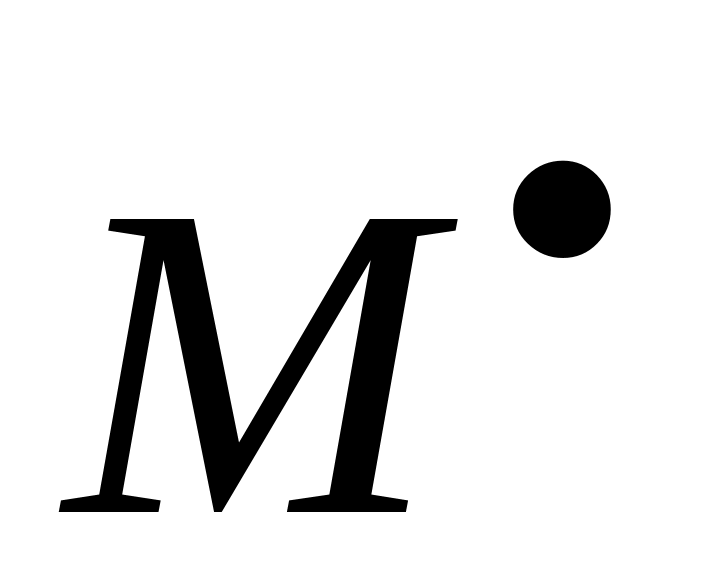
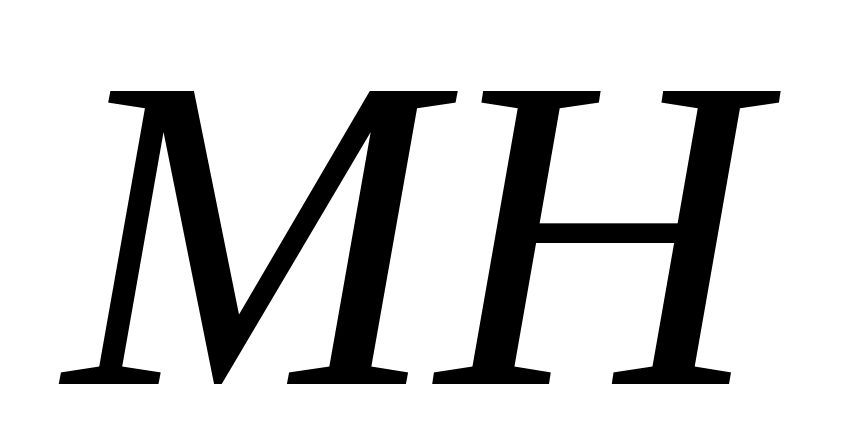
Передача цепи на инициатор – это взаимодействие макрорадикала 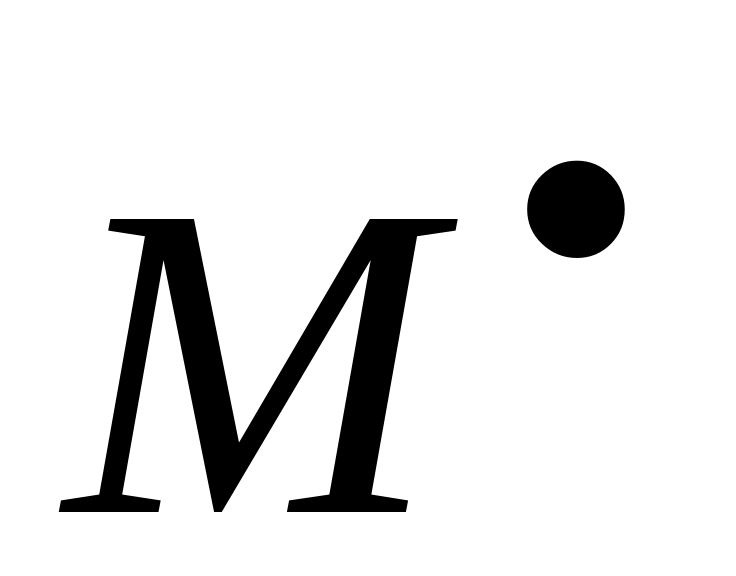
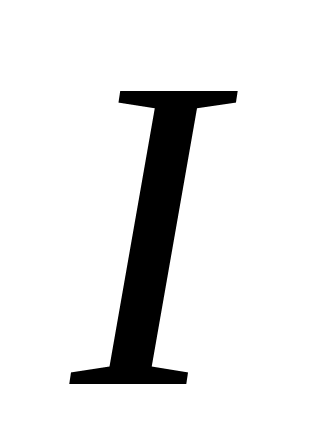
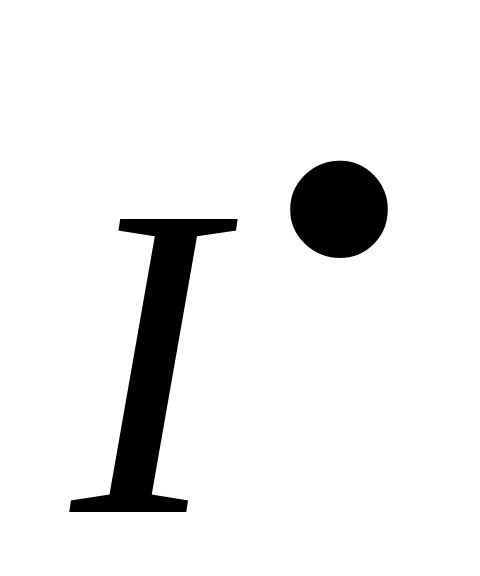
Передача цепи на растворитель – это взаимодействие макрорадикала с растворителем 
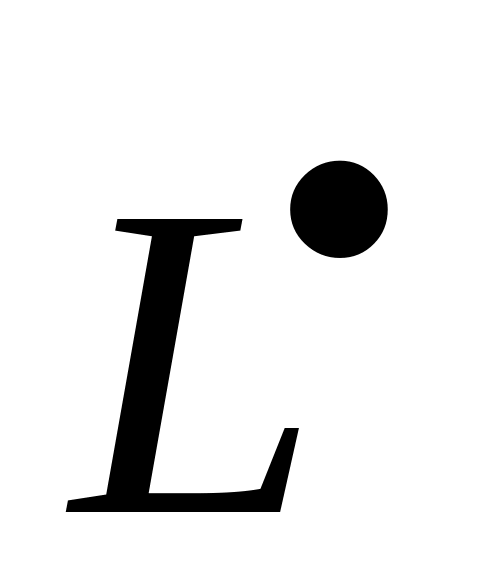
Передача цепи на полимер – процесс взаимодействия макрорадикалов с полимером 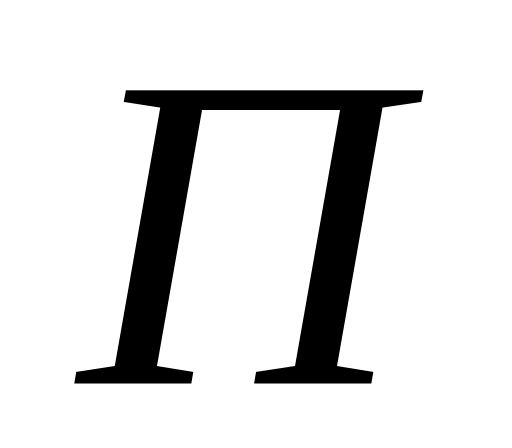
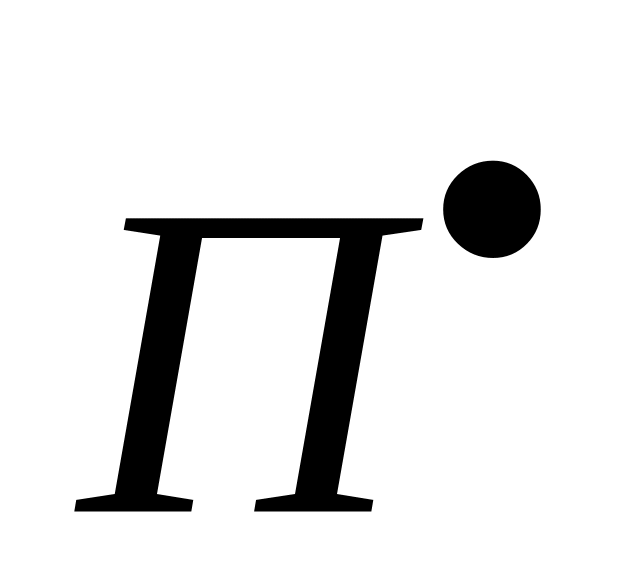
Отношение константы скорости реакции передачи цепи к константе скорости реакции роста цепи называется константой передачи цепи.
Схемы реакций, уравнения скорости передачи цепи и констант передачи цепи даны в табл. 10. Здесь 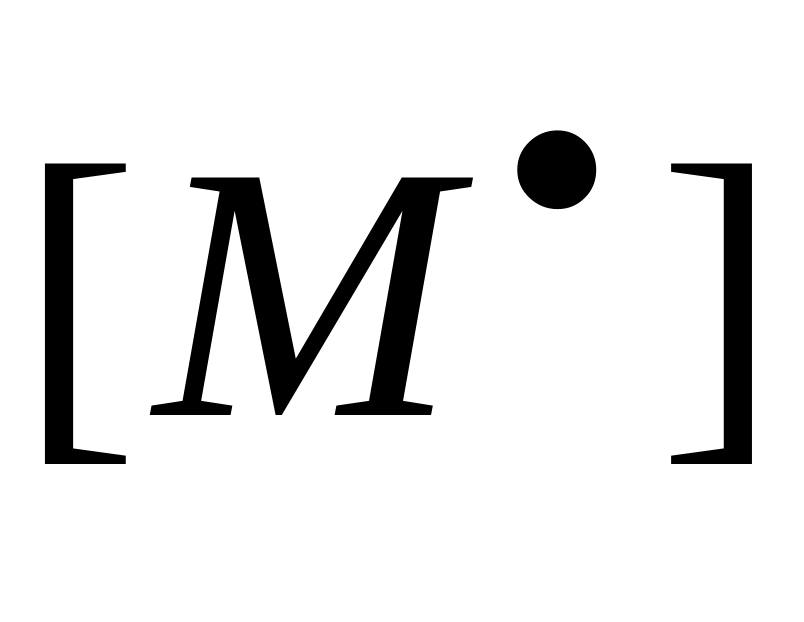
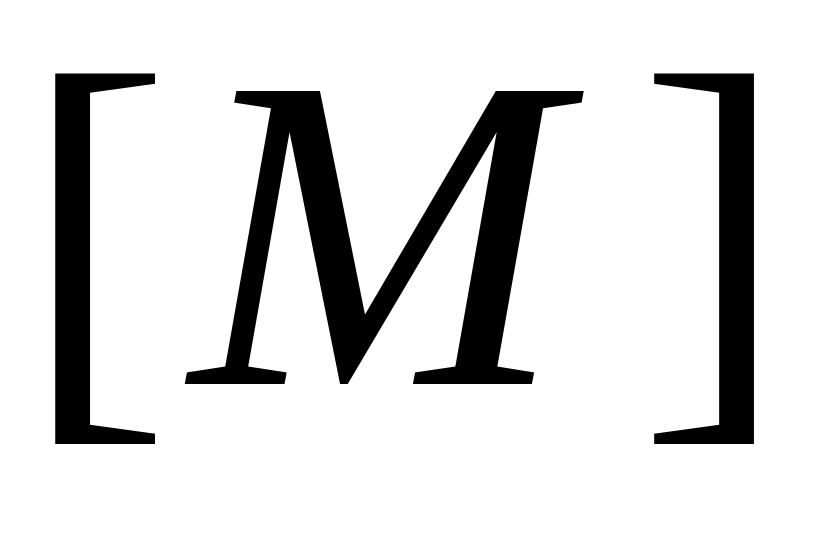
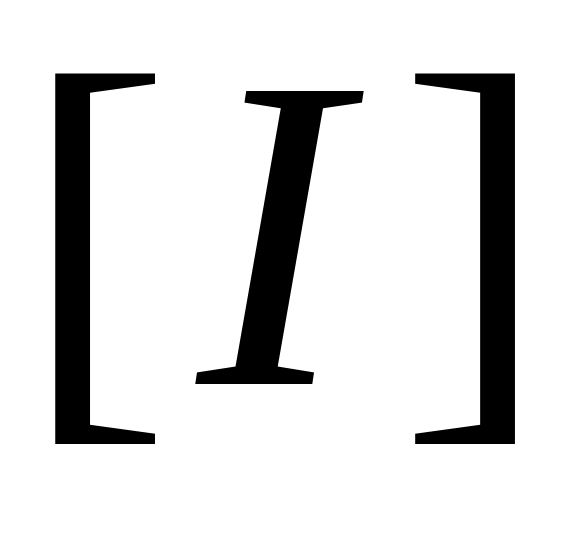

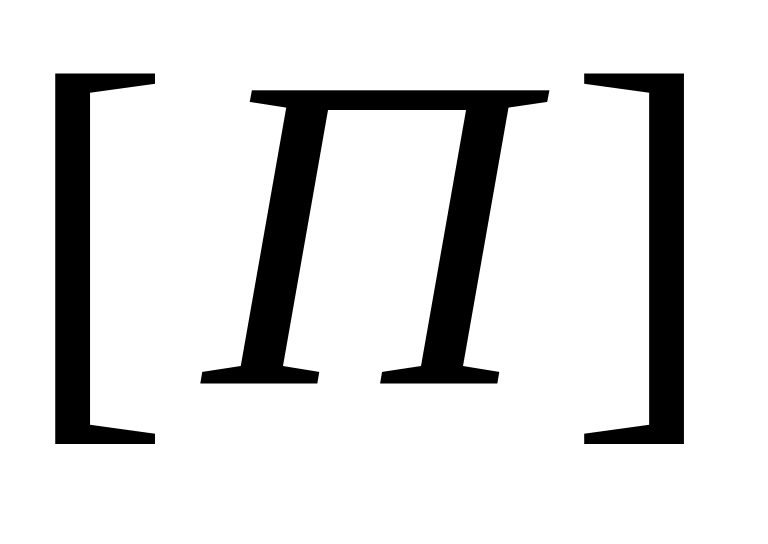
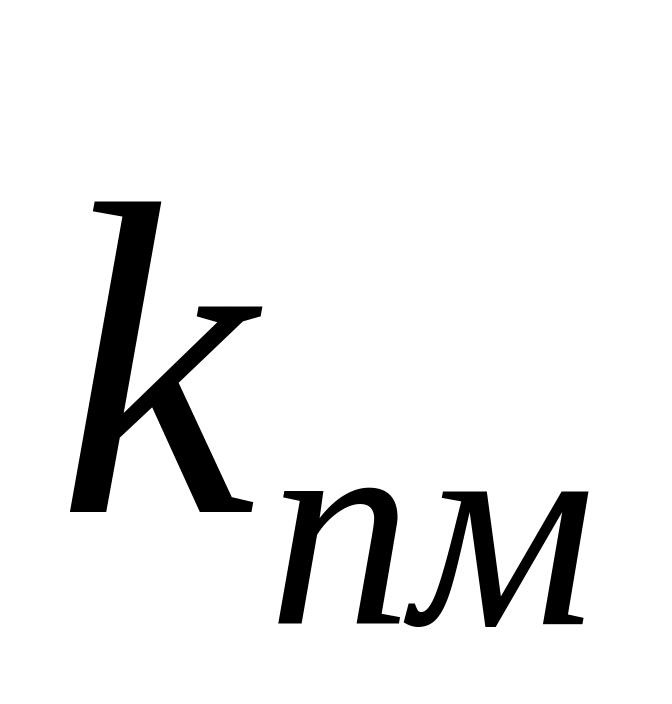
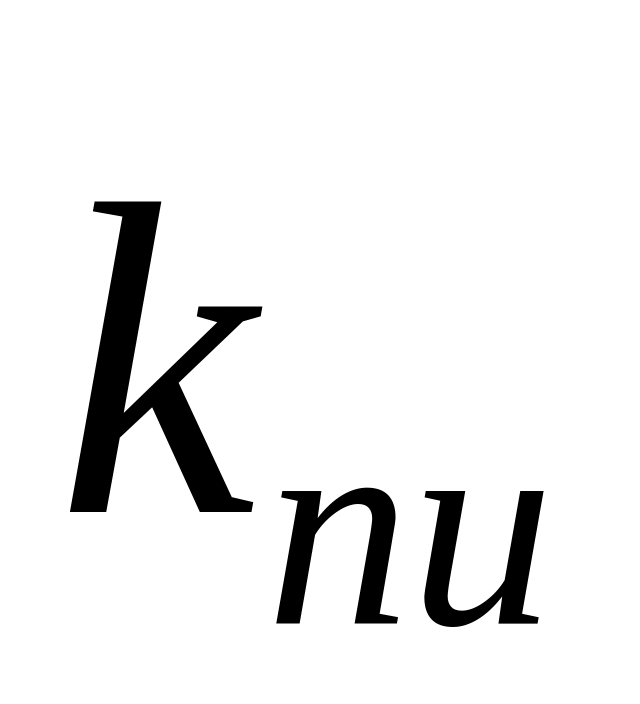
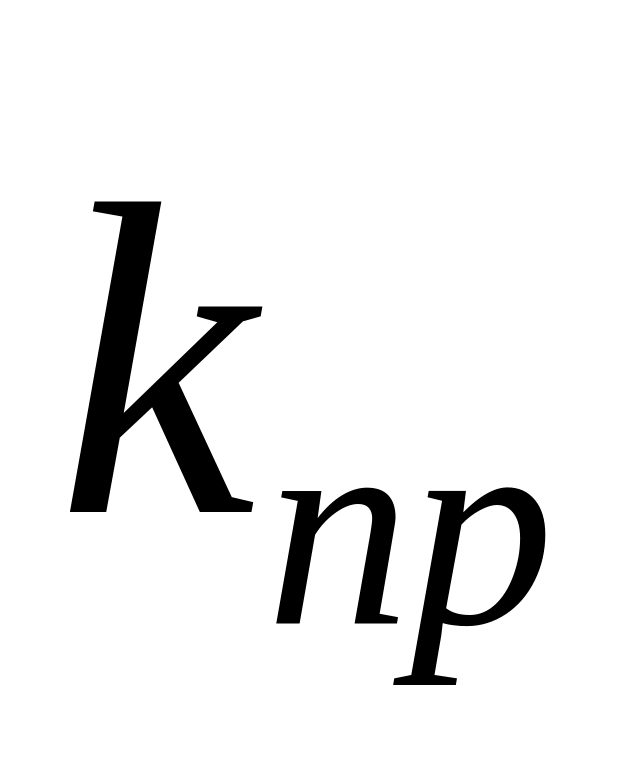
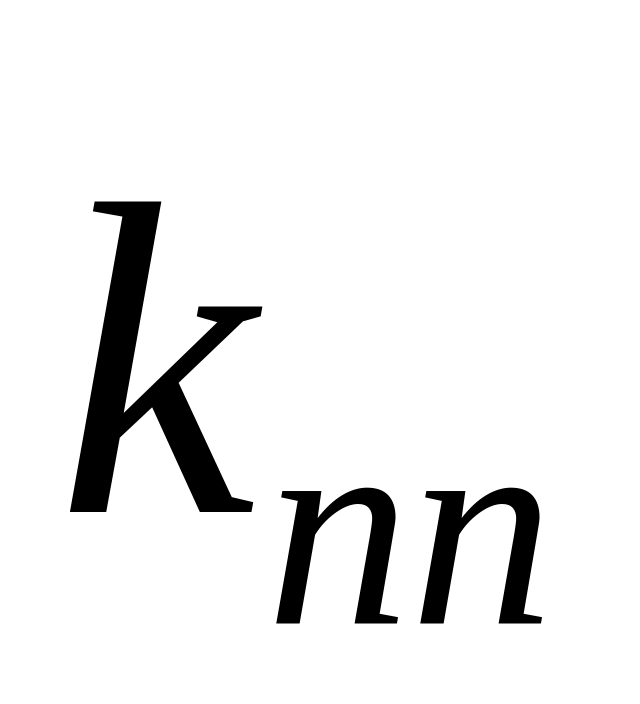
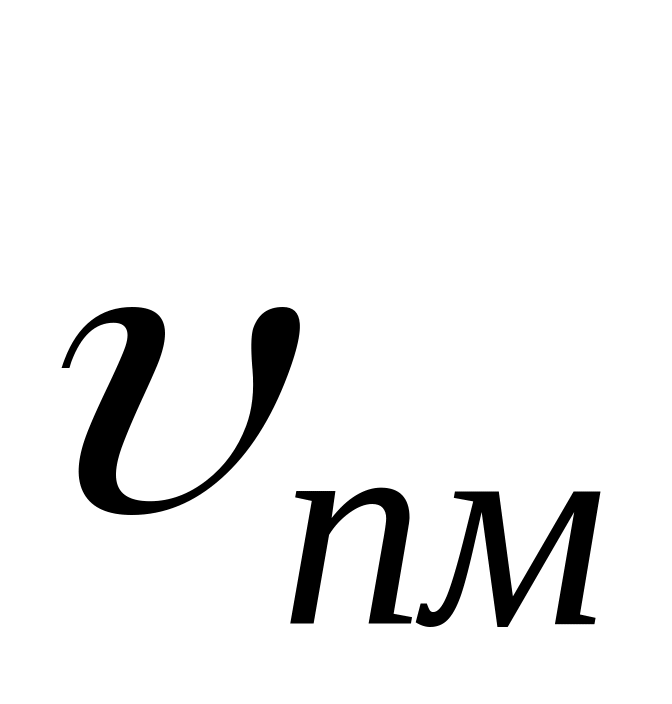
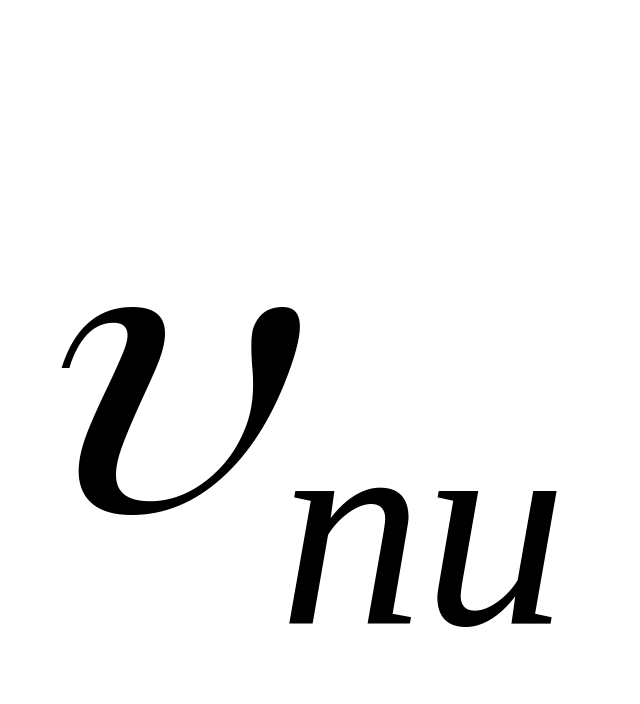
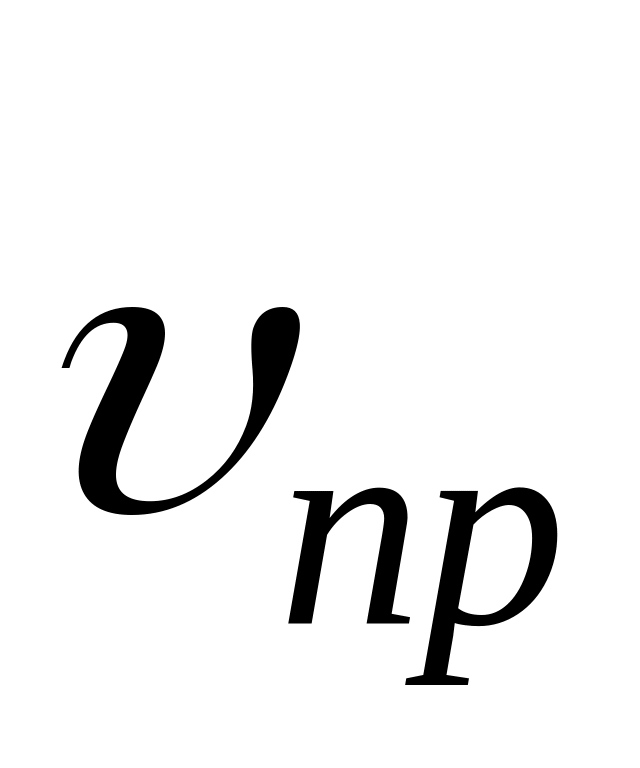
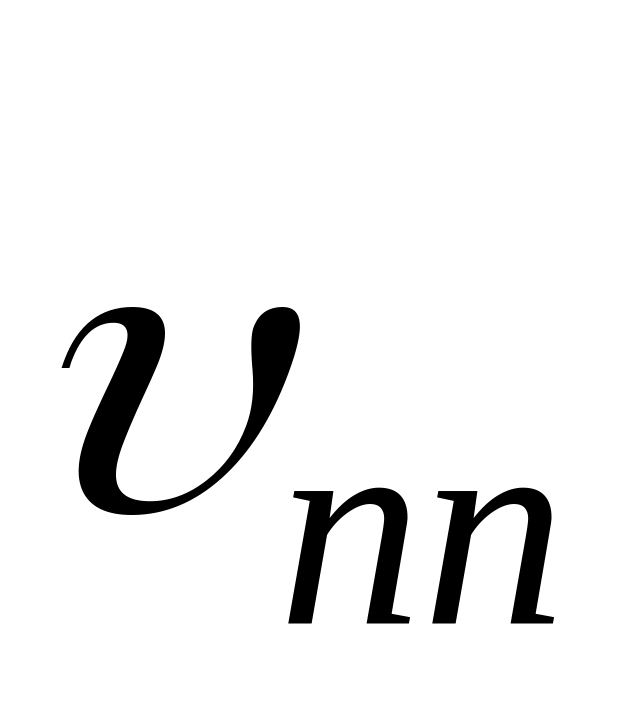
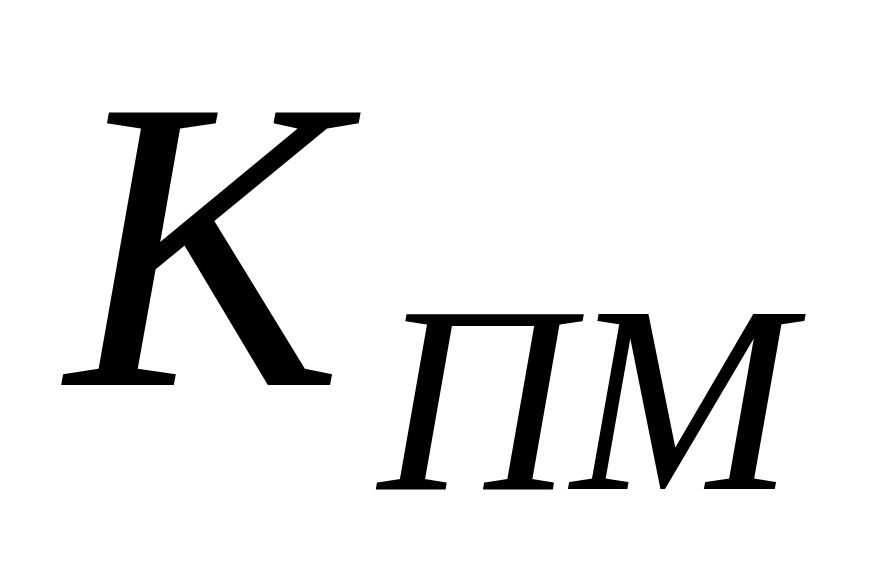
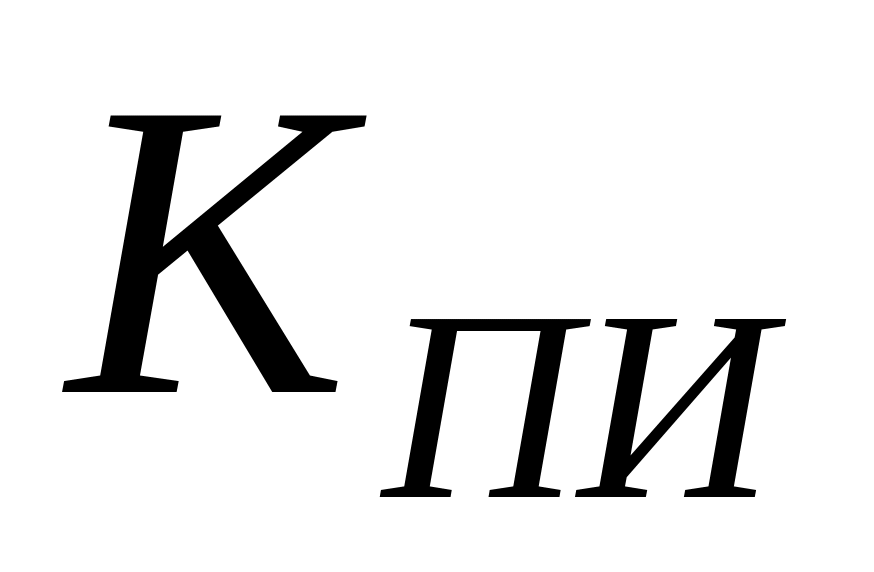
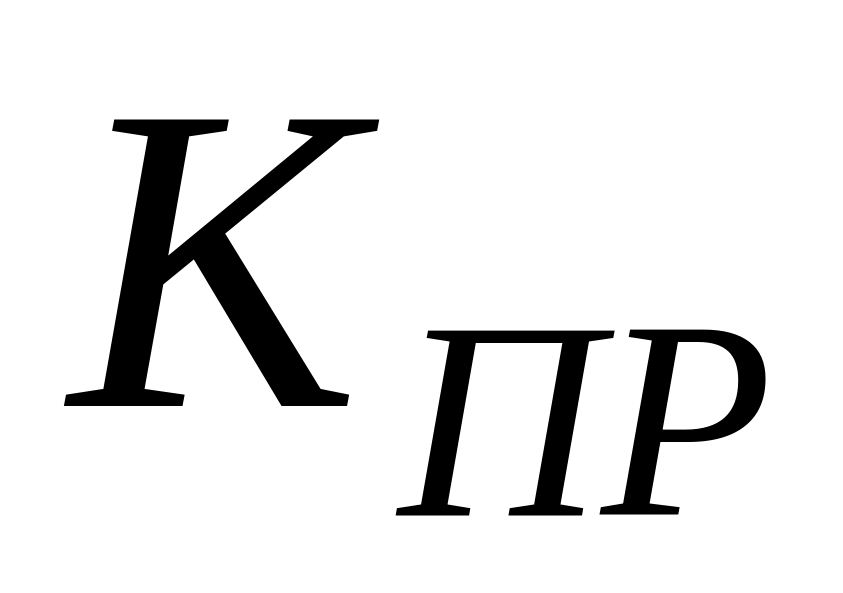
Очевидно, что реакция передачи цепи на мономер конкурирует с реакцией роста цепи. Образование полимера возможно в случае, когда 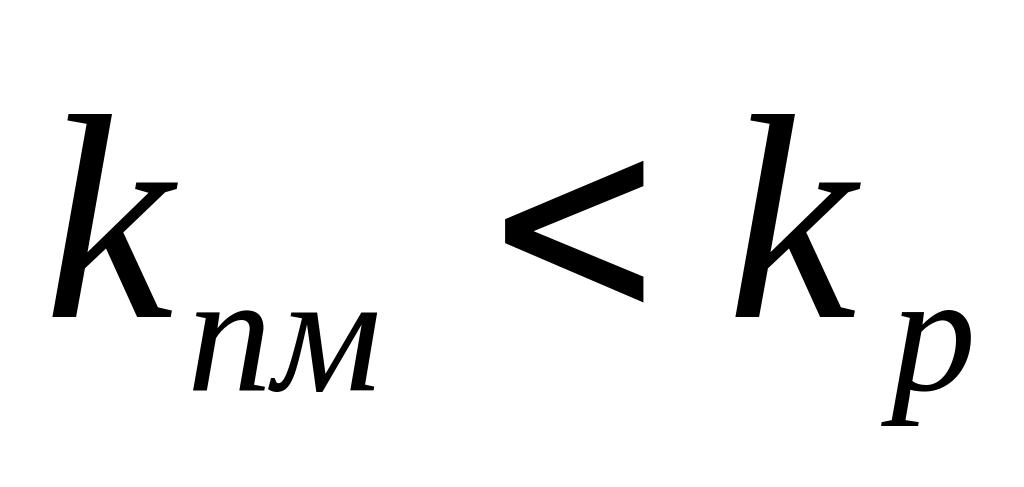
Таблица 10. Количественные характеристики различных способов
Источник