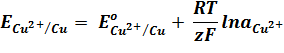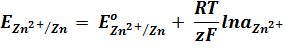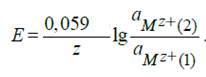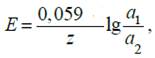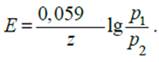Гальванические элементы. Эдс.
При прохождении электрического тока через электролит на поверхности электродов протекают электрохимические реакции. Протекание электрохимических реакций может порождаться внешним источником тока. Возможно и обратное явление : электрохимические реакции, протекающие на двух электродах, опущенных в электролит, порождают электрический ток, причем реакции идут только при замкнутой цепи (при прохождении тока).
Электрохимическим (или гальваническим) элементом называется устройство для получения электрического тока за счет электрохимических реакций. Простейший электрохимический элемент состоит из двух металлических электродов (проводников первого рода), опущенных в электролит (проводник второго рода) и соединенных между собой металлическим контактом. Несколько электрохимических элементов, соединенных последовательно, образуют электрохимическую цепь.
Важнейшей количественной характеристикой электрохимического элемента является электродвижущая сила (ЭДС, Е), которая равна разности потенциалов правильно разомкнутого элемента (такого, у которого к конечным электродам элемента присоединены проводники первого рода из одного и того же материала).
Если при прохождении электрического тока в разных направлениях на поверхности электрода протекает одна и та же реакция, но в противоположных направлениях, то такие электроды, а также элемент или цепь, составленные из них, называются обратимыми. ЭДС обратимых элементов является их термодинамическим свойством, т.е. зависит только от Т,Р, природы веществ, составляющих электроды и растворы, и концентрации этих растворов. Пример обратимого элемента элемент Даниэля-Якоби :
в котором каждый электрод обратим. При работе элемента идут следующие реакции : Zn Zn 2+ + 2e , Cu 2+ + 2e Cu. При пропускании тока бесконечно малой силы от внешнего источника на электродах протекают обратные реакции.
Пример необратимого элемента элемент Вольта :
При работе элемента протекают реакции : Zn Zn 2+ + 2e , 2H + + 2e H2 . При пропускании тока от внешнего источника электродными реакциями будут : 2H + + 2e H2 , Cu Cu 2+ + 2e .
ЭДС электрохимического элемента является величиной положительной, т.к. она соответствует определенному самопроизвольно протекающему процессу, дающему положительную работу. Обратному процессу, который не может протекать самостоятельно, отвечала бы отрицательная ЭДС. При составлении цепи электрохимических элементов процесс в одном из элементов можно направить так, чтобы он сопровождался затратой работы извне (несамопроизвольный процесс), используя для этого работу другого элемента цепи, в котором идет самопроизвольный процесс. Суммарная ЭДС любой цепи равна алгебраической сумме положительных и отрицательных величин. Поэтому очень важно при записи схемы цепи учитывать знаки ЭДС, пользуясь принятыми правилами.
ЭДС электрохимической цепи считается положительной, если при записи цепи правый электрод заряжен положительно относительно левого (катионы при работе цепи проходят в растворе от электрода, записанного слева, по направлению к электроду, записанному справа, и в этом же направлении движутся во внешней цепи электроны). Пример.
Источник
Электрохимические цепи



Различают два основных вида электрохимических цепей – химические и концентрационные.
В химических цепях источником электрического тока является протекающая в системе окислительно–восстановительная химическая реакция.
Многие химические реакции являются окислительно-восстановительными. Например, при погружении цинковой пластинки в раствор сульфата меди самопроизвольно протекает реакция
в результате, которой атомы цинка окисляются, а ионы меди восстанавливаются. При таком проведении процесса энергия химической реакции превращается в тепловую энергию, но если провести процессы окисления и восстановления раздельно и осуществить передачу электронов через внешнюю цепь, можно использовать энергию химической реакции для совершения работы. В этом случае электрохимическая цепь действует как источник тока.
Гальваническими элементами ГЭ называются электрохимические цепи, в которые дают возможность получать ток за счет самопроизвольно протекающих в обычных условиях химических реакций.
Элемент (или устройство), в котором энергия химической реакции преобразуется в электрическую называется гальваническим элементом.
ГЭ состоит как минимум из 2-х электродов; на одном из которых всегда идет процесс окисления (отрицательный электрод, анод), а на другом – процесс восстановления (положительный электрод, катод).
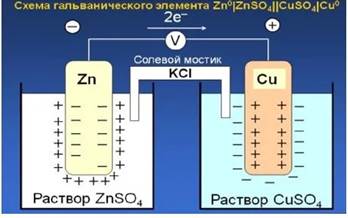
Одним из наиболее простых гальванических элементов является элемент Даниэля-Якоби, состоящий из двух электродов – цинкового и медного, погруженных в соответствующие растворы сульфатов цинка и меди, и соединенных солевым агар-агаровым мостиком.
Для устранения диффузионного потенциала растворы соединяют электролитическим мостиком, который представляет собой изогнутую стеклянную трубку наполненную насыщенным раствором электролита (например КСl), у которого подвижности К + и А — приблизительно равны. Агар-агар используют для того, чтобы удержать электролит в трубке.
Цинковый электрод по отношению к медному заряжается отрицательно. При замыкании внешней цепи цинк растворяется, происходит реакция окисления:
а на медном электроде — восстановления:
Движение потока электронов по проводнику – это и есть электрический ток.
Общий процесс является суммой процессов, протекающих на отдельных электродах:
Для ГЭ принята следующая форма записи электрохимической цепи:
· Cлева записывается электрод имеющий более отрицательный потенциал (анод),
· справа – электрод, имеющий более положительное значение потенциала (катод).
· по краям цепей записываются Ме (материал электрода). Вертикальная линия обозначает границу раздела фаз Ме – раствор. Растворы обоих электродов отделяются двумя сплошными линиями, обозначающими отсутствие диффузионного потенциала (Δφдиф = 0).
Электродные полуреакции принято записывать как реакции восстановления. Поэтому общая реакция в ГЭ записывается как разность между реакциями на правом и левом электродах: слева записываются вещества в окисленной форме и электроны, справа – вещества в восстановленной форме.
Правый электрод: Cu 2+ + 2ē → Cuº.
Левый электрод: Zn 2+. + 2ē → Znº
Общая реакция: Znº + Cu 2+ → Zn 2+ + Cuº.
Важной характеристикой ГЭ является его электродвижущая сила (ЭДС). Электродвижущая сила элемента равна разности потенциалов на концах правильно разомкнутой равновесной цепи. ЭДС обозначают E, которую рассчитывают по формуле:
где Е+ и Е– — потенциал положительного и отрицательного электродов соответственно.
Е о = Е о + – Е о –,
где Е о + и Е о – — стандартный потенциал положительного и отрицательного электродов соответственно
Электрохимическая цепь называется правильно разомкнутой, если она начинается и заканчивается одним и тем же металлом. В системе СИ ЭДС измеряется в вольтах.
ЭДС всегда положительна, поскольку она соответствует определенному самопроизвольно протекающему процессу, дающему положительную работу. ЭДС цепи отражает все процессы, происходящие на границе раздела фаз в равновесной цепи.
Для гальванического элемента Даниэля – Якоби ЭДС равна:
Согласно уравнению Нернста
Вычитая второе уравнение из первого, получим выражение для ЭДС медно-цинкового гальванического элемента:
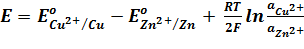
Для любого другого элемента, в основе работы которого лежит химическая реакция, ЭДС может быть вычислена по уравнению:
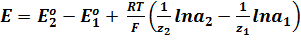
E o 1 и E o 2 – стандартные потенциалы электродов;
z1 z2 – зарядовые числа ионов;
a1 a2 – активности ионов в растворе.
Записать схему цепи, составленной из цинкового и хлорсеребряного электродов. Определить стандартную ЭДС цепи.
Выпишем из справочника электродные полуреакции (потенциалопределяющие) и стандартные потенциалы электродов:
Стандартная ЭДС рассчитывается по Е о = Е о + – Е о –.
Положительным в цепи будет тот электрод, который имеет больший условный потенциал. Положительным будет хлорсеребряный электрод, отрицательным – цинковый.
Е о = E o Сl ̅ / AgCl, Ag – E o Zn2+/Zn = 0,222 – (–0,763) = 0,985 В.
Схема цепи Zn | Zn 2+ | | Сl ̅ | AgCl, Ag
Реакции в гальваническом элементе:
| Катод | Сl ̅ | AgCl, Ag | AgCl + e = Agº + Cl – |
| Анод | Zn 2+ | Zn | Zn 2+. + 2ē → Znº |
| Суммарная реакция |