- Цепь переноса электронов (цпэ).
- Структурная организация цепи переноса электронов (цпэ).
- Компоненты цпэ:
- Варианты дыхательной цепи.
- 1. Полная дыхательная цепь
- 2. Сокращенная (укороченная) дыхательная цепь
- 3. Максимально сокращенная (максимально укороченная) дыхательная цепь.
- Окислительное декарбоксилирование пировиноградной и -кетоглутаровой кислот в митохондриях
- Варианты дыхательной цепи.
- 1. Полная дыхательная цепь
- 2. Сокращенная (укороченная) дыхательная цепь
- 3. Максимально сокращенная (максимально укороченная) дыхательная цепь.
- Окислительное декарбоксилирование пировиноградной и -кетоглутаровой кислот в митохондриях
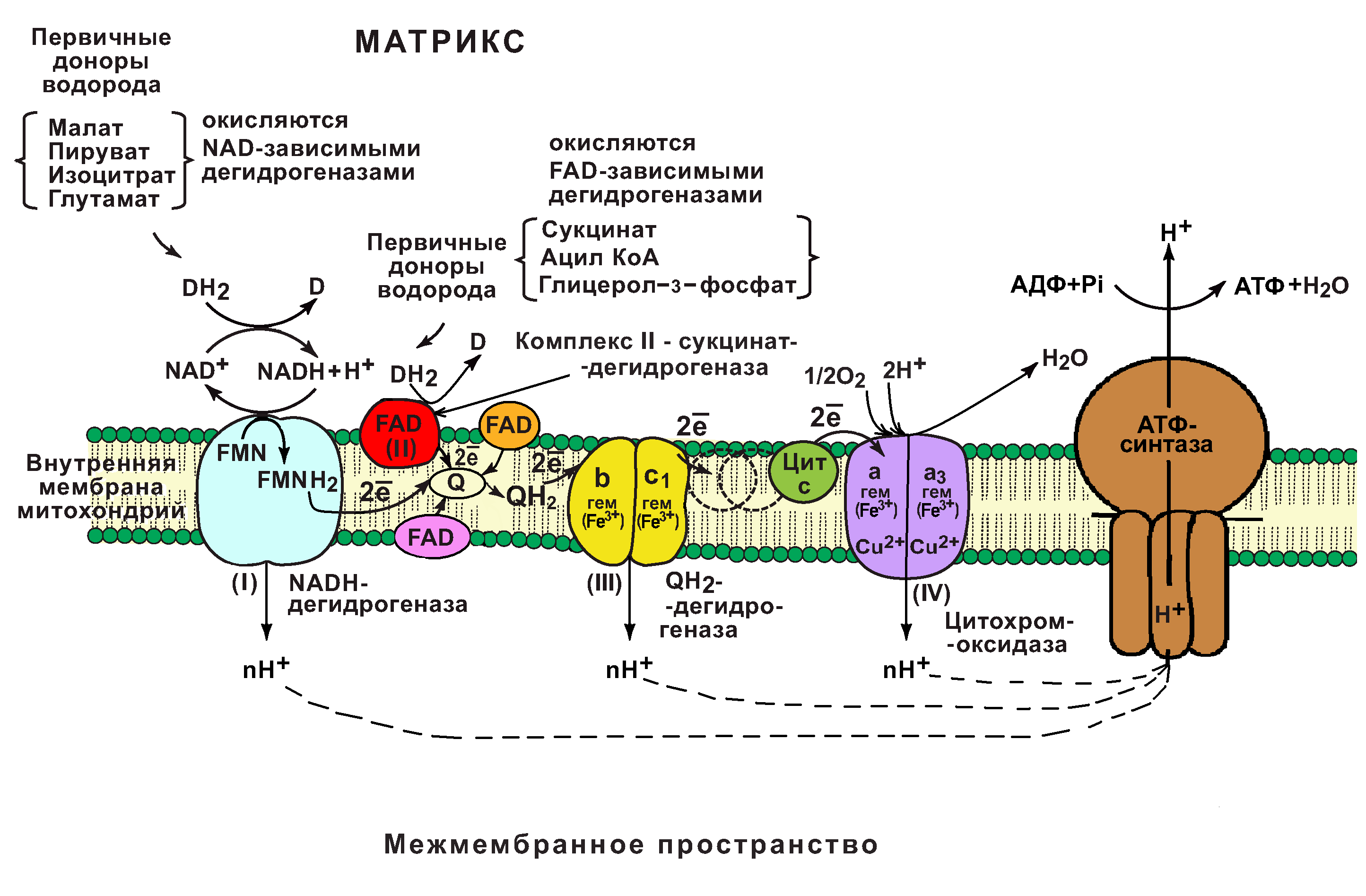
Цепь переноса электронов (цпэ).
Цепь переноса электронов (дыхательная цепь) – это сложная система переносчиков, при участии которой происходит процесс последовательного переноса электронов от NADH и FADH2 на O2.
Дыхательной цепи предшествует отнятие атомов водорода от окисляемых субстратов (реакции дегидрирования).
Эти реакции относятся к окислительно-восстановительным.
Их катализируют ферменты оксидоредуктазы (подкласс: дегидрогеназы).
Бóльшая часть окислительно-восстановительных реакций в клетке происходит в матриксе митохондрий.
Реакции дегидрирования происходят в ходе специфических и общего пути катаболизма.
Выделяют 2 типа дегидрогеназ, катализирующие реакции дегидрирования, предшествующие ЦПЭ:
NAD + – зависимые дегидрогеназы (предшественник: витамин PP);
! Субстратов NAD + – зависимых дегидрогеназ большинство.
Примеры: малат, изоцитрат, -кетоглутарат, глутаминовая кислота и др.
Кофермент NAD + не образует прочной постоянной связи с ферментом.
Он соединяется с АЦ фермента уже в ходе реакции и после её завершения уже в восстановленной форме отсоединяется.
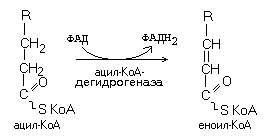
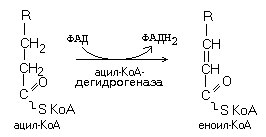
FAD – зависимые дегидрогеназы (предшественник: витамин B2)
Кофермент FAD прочно связан с активным центром фермента как в окисленной, так и в восстановленной форме.
В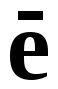
переходит в восстановленную форму.
Субстраты FAD-зависимых дегидрогеназ: сукцинат, ацил-KoA, глицерол-3-фосфат (-глицерофосфат).
Структурная организация цепи переноса электронов (цпэ).
В основе функционирования ЦПЭ лежит работа 5 основных компонентов, обеспечивающих перенос электронов от NADH и FADH2 на O2.
В их число входит 3 сложных ферментных комплексов, а также 2 низкомолекулярных переносчика.
Компоненты цпэ:
NADH-дегидрогеназа (комплекс I);
сукцинатдегидрогеназа (комплекс II);
низкомолекулярный переносчик: убихинон (кофермент Q);
Убихинолдегидрогеназа (QН2-дегидрогеназа) (комплекс III);
низкомолекулярный переносчик (цитохром с);
цитохромоксидаза (комплекс IV)
Все компоненты ЦПЭ располагаются во внутренней мембране митохондрий в порядке возрастания окислительно-восстановительных потенциалов (редокс-потенциалов).
Самый низкий редокс-потенциал у NADH (-0,32В), а самый высокий редокс-потенциал у кислорода (+0,82В).
Это обеспечивает последовательное перемещение электронов от NADH (или FADH2) на O2, при котором происходит выделение энергии на каждом этапе ЦПЭ.
ЦПЭ обеспечивает взаимосвязь (сопряжение) процессов окисления и фосфорилирования АДФ.
Основная роль в переносе электронов принадлежит 3 важнейшим ферментным комплексам (I, III, IV).
Это сложные олигомерные белки, расположенные во внутренней мембране митохондрий.
Источник
Варианты дыхательной цепи.
1. Полная дыхательная цепь
В этой цепи окисляется небольшое количество субстратов, из которых главными являются четыре. Коэффициент Р/О=3.
НИКОТИНАМИДНЫЕ ФЕРМЕНТЫ, ИХ ОКИСЛЯЮЩИЕ
изолимонная кислота (изоцитрат)
Глутаминовая кислота (глутамат)
Все ферменты полной цепи являются НАД-зависимыми дегидрогеназами.
2. Сокращенная (укороченная) дыхательная цепь
Известны два субстрата. Главным из них является сукцинат (янтарная кислота).
Сукцинатдегидрогеназа – это комплекс II, который в укороченном варианте цепи является начальным звеном окисления. В составе комплекса – простетическая группа ФАД и FeSII. От ФАД . Н2 два атома водорода переносятся на KoQ. Значит, первое звено, которое имеется в полной цепи — исключается. Перепад окислительно-восстановительного потенциала между ФАД и KoQ невелик. Поэтому переноса H + в межмембранное пространство в этой точке не происходит. + также создается, но меньший, чем в полной цепи. Значит, меньше и эффективность фосфорилирования — коэффициент Р/О=2.
Аналогичным образом окисляется и второй субстрат – ацил-КоА (активная форма любой жирной кислоты):
3. Максимально сокращенная (максимально укороченная) дыхательная цепь.
Она представлена только цитохромной частью. Эксперименты показали, что здесь может быть окислен только один субстрат — аскорбиновая кислота, с участием фермента, восстановленные эквиваленты включаются в цепь на уровне цитохрома С цитохромоксидазы (цитохром аа3), но в реальных условиях такого окисления практически не происходит. Образуется вода и 1 молекула АТФ. Коэффициент Р/О=1.
Возможность такого окисления доказана в эксперименте in vitro. А в живой клетке аскорбиновая кислота обычно используется как донор водорода в системе окисления оксигеназного типа (реакции, катализируемые монооксигеназами: смотрите лекцию «Внемитохондриальное окисление»). Такие реакции с участием витамина «С» особенно важны для формирования белка коллагена, в котором за счет монооксигеназной реакции образуется гидроксипролин.
Окислительное декарбоксилирование пировиноградной и -кетоглутаровой кислот в митохондриях
Этот вариант дыхательной цепи удлинен по сравнению с полной цепью за счет того, что первое звено катализируется не никотинамидным ферментом, а мультиферментным комплексом. Это единая надмолекулярная структура. В состав этого комплекса входят 3 фермента и 5 коферментов. Такой комплекс называется мультиферментным комплексом окислительного декарбоксилирования -кетокислот, и он окисляет два субстрата:
1. Пировиноградную кислоту (пируват, ПВК)
Окисляется с помощью ферментов пируватдегидрогеназного комплекса;
2. -кетоглутаровую кислоту (-КГ)
Окисляется с помощью ферментов -кетоглутаратдегидрогеназного комплекса.
Оба комплекса ферментов работают одинаково. Они катализируют реакции окислительного декарбоксилирования соответствующей -кетокислоты.
Источник
Варианты дыхательной цепи.
1. Полная дыхательная цепь
В этой цепи окисляется небольшое количество субстратов, из которых главными являются четыре. Коэффициент Р/О=3.
НИКОТИНАМИДНЫЕ ФЕРМЕНТЫ, ИХ ОКИСЛЯЮЩИЕ
изолимонная кислота (изоцитрат)
Глутаминовая кислота (глутамат)
Все ферменты полной цепи являются НАД-зависимыми дегидрогеназами.
2. Сокращенная (укороченная) дыхательная цепь
Известны два субстрата. Главным из них является сукцинат (янтарная кислота).
Сукцинатдегидрогеназа – это комплекс II, который в укороченном варианте цепи является начальным звеном окисления. В составе комплекса – простетическая группа ФАД и FeSII. От ФАД . Н2 два атома водорода переносятся на KoQ. Значит, первое звено, которое имеется в полной цепи — исключается. Перепад окислительно-восстановительного потенциала между ФАД и KoQ невелик. Поэтому переноса H + в межмембранное пространство в этой точке не происходит. + также создается, но меньший, чем в полной цепи. Значит, меньше и эффективность фосфорилирования — коэффициент Р/О=2.
Аналогичным образом окисляется и второй субстрат – ацил-КоА (активная форма любой жирной кислоты):
3. Максимально сокращенная (максимально укороченная) дыхательная цепь.
Она представлена только цитохромной частью. Эксперименты показали, что здесь может быть окислен только один субстрат — аскорбиновая кислота, с участием фермента, восстановленные эквиваленты включаются в цепь на уровне цитохрома С цитохромоксидазы (цитохром аа3), но в реальных условиях такого окисления практически не происходит. Образуется вода и 1 молекула АТФ. Коэффициент Р/О=1.
Возможность такого окисления доказана в эксперименте in vitro. А в живой клетке аскорбиновая кислота обычно используется как донор водорода в системе окисления оксигеназного типа (реакции, катализируемые монооксигеназами: смотрите лекцию «Внемитохондриальное окисление»). Такие реакции с участием витамина «С» особенно важны для формирования белка коллагена, в котором за счет монооксигеназной реакции образуется гидроксипролин.
Окислительное декарбоксилирование пировиноградной и -кетоглутаровой кислот в митохондриях
Этот вариант дыхательной цепи удлинен по сравнению с полной цепью за счет того, что первое звено катализируется не никотинамидным ферментом, а мультиферментным комплексом. Это единая надмолекулярная структура. В состав этого комплекса входят 3 фермента и 5 коферментов. Такой комплекс называется мультиферментным комплексом окислительного декарбоксилирования -кетокислот, и он окисляет два субстрата:
1. Пировиноградную кислоту (пируват, ПВК)
Окисляется с помощью ферментов пируватдегидрогеназного комплекса;
2. -кетоглутаровую кислоту (-КГ)
Окисляется с помощью ферментов -кетоглутаратдегидрогеназного комплекса.
Оба комплекса ферментов работают одинаково. Они катализируют реакции окислительного декарбоксилирования соответствующей -кетокислоты.
Источник