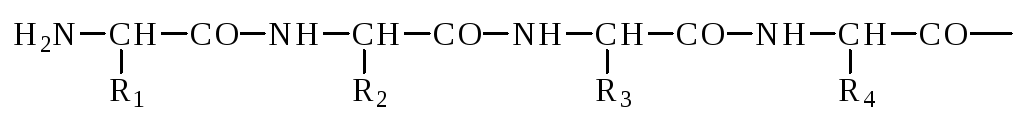Как назвать полипептидную цепь
ПОЛИПЕПТИДНАЯ ЦЕПЬ
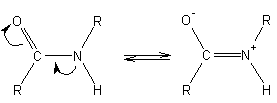
Пептидная связь образуется при реакции аминогруппы одной аминокислоты и карбоксильной группы другой с выделением молекулы воды:
( аланил-аланин )
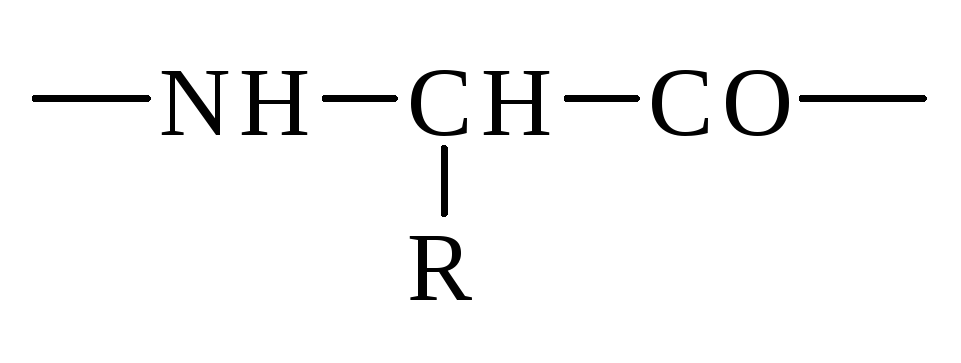
Связанные пептидной связью аминокислоты образуют полипептидную цепь.
Характерной особенностью пептидной связи является то, что 6 атомов при ней НАХОДЯТСЯ В ОДНОЙ ПЛОСКОСТИ. Это связано с тем, что связь С =О не является ПОЛНОСТЬЮ кратной, а связь С- N не является полностью простой. В реальности наличествует некая, близкая к полуторной, связь, чем и объясняется планарное расположение 6 атомов:
Вызвано это различной электроотрицательностью атомов С , N и O.
Подобное строение пептидной связи накладывает отпечаток на формирование вторичной и третичной структуры белка.
а) ОЛИГОПЕПТИДЫ (или просто ПЕПТИДЫ)- до 20 АК-остатков,
ФЕНИЛАЛАНИЛ-АЛАНИ Л — АСПАРАГИНИЛ-ГЛУТАМИНИЛ-ГИСТИДИН
б) ПОЛИПЕПТИД Ы- от 20 до примерно 50 АК-ост,
в) БЕЛК И- более 50 АК-остатков. Самым простым белком является инсулин, состоящий из ДВУХ полипептидных нитей, соединенных дисульфидными мостиками, и состоящий из 51 аминокислотного остатка. Несмотря на то, что инсулин состоит из двух полипептидных нитей (21 и 30 остатков), его считают белком третичной структуры, поскольку он образуется в результате протеолиза предшественника инсулин а- более сложного полипептида ПРОИНСУЛИНА. Провести конкретную границу между белками и полипептидами на основании только числа аминокислотных остатков в ПП-цепи нельзя. Известны пептиды, содержащие более 100 АК-остатков и белки с 51 остатком. Критерием отнесения должно служить наличие сформированной третичной структуры, которая характерна только для белков.
Белки, в зависимости от состава бывают ПРОСТЫЕ (содержащие только незамещенные остатки аминокислот в полипептидной цепи) и СЛОЖНЫЕ, состоящие кроме полипептидной нити (белковая часть), также и небелковой части, когда посредством боковых радикалов аминокислотных остатков к полипептидной цепи присоединены молекулы жирных кислот, сахаров, ацилглицеринов , другие органические группы (в том числе порфириновые ), остатки фосфорной кислоты и т.д.
К сложным белкам, в частности, относятся:
- Липопротеины (содержат остатки липидов)
- Гликопротеины (содержат остатки сахаров, масса белковой части превышает массу углеводной части)
- Протеогликаны (полисахариды, содержащие полипептидные участки)
- Фосфопротеины (остатки фосфорной кислоты)
- Металлопротеины (ионы металлов, связанные донорно-акцепторным взаимодействием с простетическими группами, типа порфиринов )
Источник
1.4. Первичная структура белков
Белки (протеины) это высокомолекулярные полимерные соединения пептидной природы (полигетероаминокислоты).
Первичная структура белков — это последовательность чередования аминокислотных остатков в полипептидной цепи (ППЦ).
Первичная структура белков является ковалентной структурой, поскольку в её основе лежит пептидная связь между -амино- и -карбоксильными группами аминокислот. Вследствие этого полипептидные цепи имеют неразветвленный характер.
Скелет (хребет, остов) полипептидной цепи состоит из регулярно повторяющихся структурных элементов
Полипептидная цепь обладает векторностью, направление цепи от N-конца (начало цепи) к C-концу (конец цепи), N-конец это конец, на котором находится свободная -аминогруппа. C-конец это конец, на котором находится свободная -карбоксильная группа. Аминокислотная последовательность белков обозначается, начиная с N-конца, с использованием трехбуквенных сокращенных названий аминокислот, например: глиалациспро. Может быть использовано и однобуквенное обозначение аминокислотных остатков в белке.
N- и C-концы в составе белков могут быть модифицированы. Аминогруппа на N-конце может быть ацетилирована, формилирована или метилирована. В ряде белков N-концевым является остаток пирролидонкарбоната (пироглутамата), не содержащий свободной аминогруппы. C-конец может быть амидирован. Модификации C-конца более редки по сравнению с N-концевыми модификациями.
Коэффициент поликонденсации белков варьирует в диапазоне от 50 до 2500. Обычно белок содержит 100-300 аминокислотных остатков. Поскольку средняя молекулярная масса одного аминокислотного остатка составляет около 110 Да, молекулярная масса белков варьирует в диапазоне от 6000 до миллионов Да.
Каждый индивидуальный белок обладает уникальной первичной структурой. Первым белком, чья первичная структура была установлена, явился инсулин. Это удалось сделать Сэнгеру. Его стратегия заключалась в следующем. Сначала он разделил две полипептидные цепи и далее провел их специфическое ферментативное расщепление на небольшие пептиды, содержащие перекрывающиеся последовательности. Затем, используя 1-фтор-2,4-динитробензол идентифицировал N-концевые остатки. Кроме того, он определил аминокислотный состав пептидов и в итоге смог установить их структуру, сравнивая последовательности перекрывающихся пептидов. В общих чертах стратегия Сэнгера сохранила свое значение до наших дней. Однако были предложены и иные подходы. Эдманом разработан метод автоматической процедуры последовательного отщепления и идентификации N-концевых аминокислотных остатков. Для расшифровки первичной структуры можно использовать рентгеноструктурный анализ. Последовательность аминокислотных остатков может быть определена по нуклеотидной последовательности матричной РНК.
В настоящее время установлена первичная структура более 2000 белков. Теоретически число различных вариантов первичной структуры белков безгранично. Даже для полипептида из 20 различных аминокислот, число возможных последовательностей составляет 2010 18 . В живой природе реализуется лишь незначительная доля возможных последовательностей, общее число которых у всех видов живых организмов оценивается величиной 10 10 -10 12. .
Первичная структура белков генетически детерминирована, т.е. последовательность аминокислот в белке определяется последовательностью нуклеотидов в ДНК. Искажения последовательности нуклеотидов ДНК приводят к возникновению аномальных белков с измененными биологическими свойствами, что является причиной молекулярной патологии. В частности, причиной серповидноклеточной анемии служит точечная мутация гена, контролирующего -цепь гемоглобина. Следствием этого является замена в 6-ом положении -цепи остатка глутамата на валин. Такая замена приводит к утрате одного отрицательного заряда в каждой из двух -цепей , что приводит к изменению конформации гемоглобина и утрате его биологической функции.
Гомологичными белками называются белки, выполняющие у разных видов одинаковые функции. Примером может служить гемоглобин: у всех позвоночных он выполняет одну и ту же функцию, связанную с транспортом кислорода. Гомологичные белки характеризуются наличием во многих положениях одних и тех же аминокислот. Как оказалось, число аминокислотных остатков, по которым различаются гомологичные белки пропорционально филогенетическому различию между данными видами. Например, молекулы цитохромов С лошади и дрожжей различаются по 48 аминокислотным остаткам, тогда как те же молекулы курицы и утки – только по 2 остаткам. Что касается цитохромов С курицы и индейки, то они имеют идентичные аминокислотные последовательности. Сведения о числе различий в аминокислотных последовательностях гомологичных белков из разных видов используют для построения эволюционных карт, отражающих последовательные этапы возникновения и развития различных видов животных и растений в процессе эволюции.
Первичная структура, являясь простейшим уровнем структурной организации, определяет более высокие уровни организации белковой молекулы.
Источник
Номенклатура пептидов



Как видно из схемы образования пептидов, полипептидная цепь имеет определенное направление, поскольку каждый из ее строительных блоков (аминокислотных звеньев, или остатков аминокислот) имеет разные концы – либо N-амино, либо С-карбоксильная группа. Аминокислотный остаток, находящийся на том конце молекулы, где имеется свободная α-аминогруппа, называется N-концевым остатком (N-конец молекулы), а остаток на противоположном конце, несущем свободную карбоксильную группу, – С-концевым (С-конец молекулы). Например, для трипептида:
N – конец → (H2N) ала – гли – три (OH) ← С-конец
Условно принято считать, что полипептидная цепь начинается с N-конца, т.е. конца, несущего α-аминогруппу. Для условной записи пептидов используют трехбуквенные сокращения сокращенные обозначения α-аминокислот (см., с.5). При изображении последовательности аминокислот в пептидной цепи начинают с N-концевого остатка. Так, в трипептиде ала – гли – три аланин несет концевую аминогруппу, а триптофан – концевую карбоксильную группу. Обратите внимание, что три – гли – ала – это уже другой трипептид!
Названия пептидов образуют из тривиальных названий аминокислотных остатков в соответствии с их последовательностью, начиная с N-концевого остатка. С-концевой остаток сохраняет свое тривиальное название. Названия аминокислотных остатков производят из названий соответствующих аминокислот путем замены их окончания на окончание «ил», характерного для названий одновалентных остатков (радикалов). Например, глиц ин (остаток – глиц ил), вал ин (остаток – вал ил), фенилалан ин (остаток – фенилалан ил), аспараг ин (остаток – аспараг ил), аспарагин овая кислота (остаток – аспарагин ил) и т.д.
Название трипептида ала – гли – три будет следующим: аланил – глицил – триптофан.
Если аминокислотный остаток повторяется в цепи более одного раза подряд, то перед его названием используют соответствующую приставку: 2 раза – ди, 3 – три, 4 – тетра и т.д. Например, пентапептид лиз – (про)2 – тир – глн будет иметь название: лизил – дипролил – тирозил – глутамин.
При наличии в пептиде в качестве С-концевого остатка глутаминовой или аспарагиновой кислоты, их называют одним словом – глутамат и аспартат соответственно. Например, название тетрапептида про – иле – асп – асп будет следующим: пролил – изолейцил – аспарагинил – аспартат.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями: 


Источник