- Источник тока батарейка сообщение
- Как работает батарейка
- Как устроена батарейка
- Обратная реакция
- Типы батареек
- Что это такое солевые батарейки
- Алкалиновые (щелочные) батарейки что это такое
- Литиевые батарейки — что это такое?
- Принцип работы
- Разновидности батареек
- Особенности устройства разных видов батареек
- Цилиндрические
- Квадратные
- Дисковые
- Устройство батареи телефона
- Примерный химический состав всех батареек
- Что такое батарейка
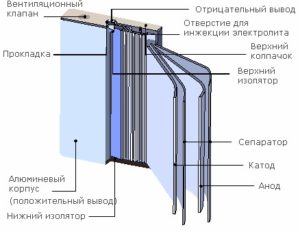
- Устройство батарейки
- Принцип работы батарейки
- Разновидности
- Солевые
- Щелочные
- Серебряные
- Ртутные
- Литиевые
- Применение
- Выбор источника питания
- История батарейки — гальванического элемента
- Эволюция батарейки — солевой гальванический элемент
- Как работает сухая батарейка (солевой гальванический элемент)
- Что находится внутри щелочной батарейки
- Как работает батарейка
- Как работает батарейка — видео
Источник тока батарейка сообщение
Примерно в 1800 году итальянский физик Алессандро Вольта изобрёл батарейку, которой мы и по сей день продолжаем пользоваться. Кстати, кто не знает что такое батарейка, так это источник питания, который вырабатывает электричество под действием химического процесса. То есть батарейка это гальванический элемент, работающий на химической реакции. Так можно объяснить и детям.
Как работает батарейка
Катоды выполняют функцию восстановителя, т.е. принимают электроны от прибывшего анода. Электролит это среда, в которой перемещаются ионы, которые образуются в процессе химической реакции. В процессе работы батарейки постепенно образовываются новые вещества, а электроды постепенно разрушаются — батарейка садится.
Вот и вся работа батарейки, кстати, все процессы, проходящие в гальваническом элементе, необратимы, то есть заряжать батарейки нельзя. Кратко говоря о работе батарейки: анод — нагрузка — катод — электролит.
Электролит изначально изготовляли в жидком виде, но это неудобно, так как при переворачивании батарейки она просто не работала. Из-за этого электролит стали загущать, превращать его в сухой вид.
Как устроена батарейка
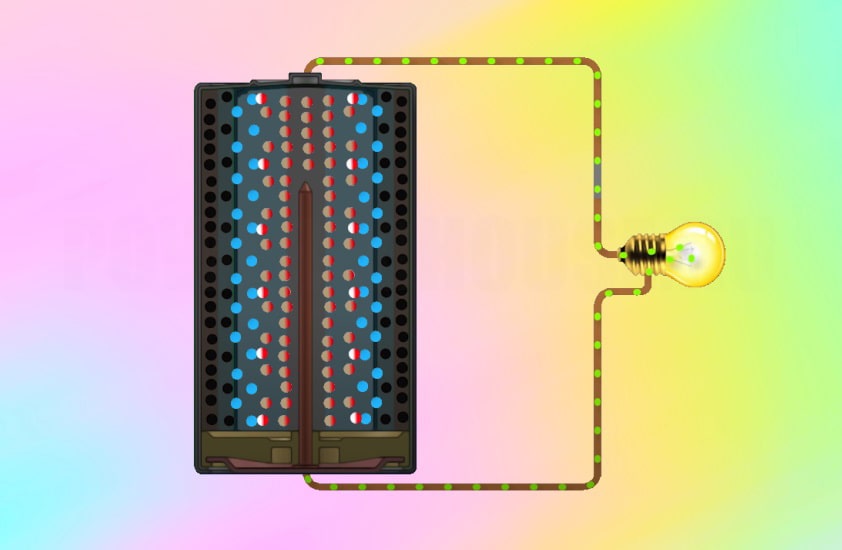
Внутри металлического корпуса щелочной ячейки находятся три основных химических вещества: цинк, диоксид марганца и гидроксид калия.
Щелочная батарейка. /Роджер Кларк
Когда элемент подключен к цепи — например, к лампочке, — цинк внутри реагирует с диоксидом марганца и теряет электроны.
Электроны собираются с помощью металлического стержня внутри ячейки, что позволяет им течь из нижней части ячейки (отрицательный), через провода к лампе (чтобы она загорелась), а затем обратно в верхнюю часть ячейки. (положительный).
Эта реакция производит около 1,5 вольт электроэнергии. Поскольку не так много устройств могут работать при напряжении 1,5 В, очень часто два или четыре элемента используются вместе для увеличения мощности. Таким образом, четыре ячейки, соединенные вместе (конец в конец), дадут шесть вольт.
Но помните, что большинство элементов и батарей можно утилизировать, поэтому убедитесь, что вы тщательно от них избавились.
Обратная реакция
Все типы батареек и элементов имеют сходный тип химической реакции, происходящей для выработки электроэнергии.
Но в некоторых типах элементов или батарей химические вещества различны, и реакция может быть обратной. Таким образом, элементы могут быть перезаряжены — так же, как литий-ионные аккумуляторы в автомобилях или смартфонах.
Раньше было гораздо дешевле производить неперезаряжаемые элементы, такие как щелочные элементы, поэтому они использовались очень широко.
Но теперь, когда люди осознали, насколько вредно для окружающей среды просто выбрасывать неперезаряжаемые элементы, а поскольку перезаряжаемые элементы становятся дешевле, мы, вероятно, будем использовать неперезаряжаемые элементы все меньше и меньше в будущем.
Типы батареек
Что это такое солевые батарейки
Солевая батарейка изготавливается из пассивного угля и двуокиси марганца, электролит из хлорида аммония и катод из цинка. В перерывах работы элементы питания могут восстанавливаться, т.е. выравнивать локальные неоднородности в композите электролита, вызванных разрядом. Такой процесс немного продлевает срок службы батарейки.
Алкалиновые (щелочные) батарейки что это такое
В отличие от солевых батарей у алкалиновой батарейки химический элемент электролита — щелочной. Щёлочные батарейки (алкалин) имеют продолжительный срок хранения, а в процессе эксплуатации напряжение на электродах меняется гораздо меньше, чем у элементов с солевым раствором.
Литиевые батарейки — что это такое?
Самые современные. В отличие от щелочных и солевых батареек, в состав катода входит литий (Li – наивысший отрицательный потенциал), в состав анода — различные материалы. Электролит — органический электролит. В связи с такими элементами литиевые батарейки получили большой срок хранения, большую плотность энергии и различную рабочую температуру.
Работа батарейки заключается в преобразовании химической энергии в электрическую.
Принцип работы
Это и есть принцип работы классической батарейки. Процессы, протекающие в ней, необратимы. Это говорит о том, что перезарядить источник питания не получится.
Разновидности батареек
Выделяют несколько основных видов, разница между которыми – в материалах, используемых для производства, и таких компонентах как электролит, анод и катод.
Состав – не единственный классификатор. Источники питания также различаются формой, габаритами и пр.
Особенности устройства разных видов батареек
От размеров и формы изделия зависят его конструкционные особенности. Рассмотрим, какие встречаются батарейки.
Цилиндрические
В центре корпуса батарейки находится графитовый стержень – положительный вывод. В ходе эксплуатации на одну из сторон надевается защитный колпачок, уберегающий от повреждений. Между стержнем и минусовой оболочкой помещен электролит и смесь для деполяризации.
- A23 – мини-мизинчиковые;
- AA – пальчиковые;
- ААА – мизинчиковые.
Параметр напряжения – до 6 В.
Квадратные
Дороже младших собратьев, массивнее. Есть солевые и щелочные модели. Особенность – в корпусе размещено 6 компактных источников питания по 1.5 В. Каждое отдельное изделие работает по аналогии с пальчиковой или другой батареей.
Выбирая такой элемент питания, необходимо смотреть на размеры, так как одинаковые модели, но разных производителей, могут отличаться на 1 – 2 мм. Причина – разная толщина оболочки, уберегающей от повреждений.
Дисковые
Ассортимент широкий, и подбирая замену, необходимо отталкиваться от прибора, для которого она берется. Как минимум, учитывают габариты установочного места.
Устройство батареи телефона
Устройство батареи смартфона.
Батарея, то есть аккумулятор смартфона – элемент, накапливающий запас энергии, необходимый для работоспособности гаджета в течение часов.
Во многих мобильниках стоят литий-ионные (Li-ion) АКБ, состоящие из двух ключевых частей: пары электродов и электролита. Электроды делают из разных материалов – лития, графита и т.д., и все они подразумевают работу с литием в основе.
Литий – активный метал, то есть он вступает в реакцию с остальными элементами. В чистом виде он настолько активен, что воспламеняется на воздухе, поэтому в батареях смартфонов применяются более безопасную версию – литий оксид-кобальта.
Между двумя электродами расположен электролит – обычно жидкое вещество, пропускающее ток. Когда аккумулятор заряжен, молекулы литий оксид-кобальта задерживают электроны, и высвобождают – когда телефоном пользуются.
Примерный химический состав всех батареек
Чаще всего встречаются такие элементы как: никель, кадмий, свинец, литий, ртуть, цинк, марганец, железо, алюминий. Вещества могут комбинироваться, но все одновременно не используются никогда.
Батарейки – источники питания, используемые для работы разнообразных устройств. Подбирая замену, необходимо отталкиваться от параметров прибора-потребителя. Разновидностей немало, у каждой свои особенности. Производители внедряют новые технологии, чтобы сделать элементы питания безопаснее как для человека, так и для окружающей среды.
Батарейки являются наиболее распространенным источником питания. Современный мир не представляет себя без различной электроники, для нее необходима электроэнергия. Не всегда получается применять обычные сетевые источники, для этого и нужны гальванические элементы. Глядя на них наверняка каждый задавался вопросом из чего состоит батарейка и как она работает?
Что такое батарейка
Устройство батарейки
Иногда, забыв вынуть уже подсевшие батарейки, через некоторое время можно обнаружить, что в батарейном отсеке появилась какая-то жидкость. Это и есть потёкший электролит. Поэтому на упаковке с батарейками можно найти предупреждение о том, что севшие элементы нужно вынимать из электроприборов. Теперь вы знаете, зачем это нужно делать.
Итак, с устройством разобрались, теперь поговорим о том, как работает щелочной элемент.
Принцип работы батарейки
На аноде проходит реакция окисления цинка. Вначале образуется гидроксид цинка
На катоде проходит реакция восстановления оксида марганца IV в оксид марганца III
Zn + 2KOH + 2MnO2 + 2e − → 2e − + ZnO + 2KOH + Mn2O3
Интересно знать! В результате химических реакций внутри элемента питания происходит необратимое разрушение металлических элементов питания, батарейка теряет свою емкость.
Важно! Поскольку химические изменения в процессе разряда батарейки необратимы — они не подлежат восстановлению заряда.
Разновидности
По форме и размерам согласно мировым стандартам элементы питания разделяются на такие виды:
- АА- пальчиковая;
- ААА- мизинчиковая;
- АААА;
- С- дюймовочка;
- D- бочка;
- квадратная;
- РР3- крона;
- Источники питания миниатюрных размеров.
В настоящее время существует большое количество разнообразных источников питания. Между собой они отличаются материалами, применяемыми для изготовления электродов и электролита. Среди многочисленных батареек выделяют несколько основных видов:
Солевые
Такие гальванические элементы имеют низкую стоимость относительно аналогов, однако имеется один существенный недостаток это низкая внутренняя емкость таких батареек.
Щелочные
Основным плюсом такой батарейки является продолжительный срок службы, в процессе эксплуатации номинальное напряжение понижается с меньшей скоростью. К минусам относят повышенную стоимость.
Серебряные
В качестве электролита применяют КОН, в состав электродов включено серебро. В таких элементах отмечают значительно увеличение срока службы, повышенную энергетическую плотность, постоянное номинальное напряжение, а также полную безвредность. Недостатками являются высокая цена.
Ртутные
В строении таких батареек используется цинк в качестве металла для анода, катод выполняется из ртутного оксида. Электроды разделяются сепаратором пропитанным электролитом. Такой элемент питания способен выполнять функции аккумулятора, однако емкость будет постепенно понижаться с каждым циклом восстановления заряда. При разряде происходит слипание ртути, а при заряде образуются дендриты цинка. Во время эксплуатации не допускается разгерметизация корпуса в связи с повышенной вредностью паров ртути. К преимуществам относят сохранение длительных значений плотности энергии, емкости и напряжения.
Внимание! Ртутные источники питания являются потенциально опасными для здоровья человека и окружающей среды.
Литиевые
Данные элементы питания постепенно вытесняют все аналоги в своей области применения. Отрицательные электроды такой батарейки сделаны из лития. В них постоянно совершенствуются основные технические характеристики. К плюсам батареек с литиевым электродом относят увеличение срока хранения, широкий диапазон рабочих температур, повышенная внутренняя емкость. Основным минусом является повышенная стоимость.
Применение
Различные виды могут применяться по-разному, зависит это от их основных конструктивных свойств и характеристик:
- Элементы питания с твердым электролитом используют в устройствах с малым значением потребляемого тока. Например, часы фонарики с малой мощностью, а также пульты дистанционного управления.
- Щелочные батарейки применяют в электротехнике с повышенным значением тока, к ним можно отнести различные камеры и магнитофоны, а также игрушки с электродвигателем.
- Источники питания с серебряными электродами способны обеспечить электроэнергией в калькуляторах, переносных инструментах и аппаратах для улучшения слуха.
- Литиевые батарейки используют в портативной электронике, где необходимо стабильное значение емкости и потребляемого тока.
Выбор источника питания
Для правильного выбора элементов питания необходимо обратить внимание на следующие факторы:
- В аппаратах и оборудовании какого вида он будет применяться.
- Электролит какого состава используется в конструкции.
- Стоимость батарейки, иногда более выгодно приобрести несколько дешевых, чем один очень дорогой.
- Каждый элемент питания на корпусе имеет маркировку, по которой можно определить вид и состав источника питания.
- Необходимо ориентироваться по условиям окружающей среды в процессе эксплуатации.
- Рекомендуется приобретать источники питания, произведенные сравнительно недавно, так как с течением времени емкость может понижаться.
- Перед покупкой следует обратить внимание на целостность упаковки и самого корпуса элемента.
- Батарейка должна конструктивно соответствовать своему посадочному месту в электроприборе.
Правильный выбор и соблюдение требований к безопасной эксплуатации позволит продлить работу любого элемента питания. Для определенных видов техники необходим свой вид батарейки.
С приходом новых технологий, в каждом доме появились устройства, не имеющие постоянного источника питания.
Электричество окружает современного человека постоянно. Но даже на этом фоне удивительно, что напряжение присутствует
Батарейки имеют свойство, садится в самый неподходящий момент. Что делать, как оживить батарейку? Самый
Батарейки и аккумуляторы бытового применения оформлены ярко и броско. Внешний вид подчинён законам маркетинга.
Батарейка это прижившееся и не совсем корректное название одиночного гальванического элемента. А уже их соединение в источниках питания для создания нужного напряжения — это батарея. Поэтому не стоит путать эти определения. И если называя гальванический элемент батарейкой, мы поступаем не совсем верно (но смысл понятен), то слово батарея абсолютно никакого отношения не имеет к одиночным химическим источникам электрического тока.
Данный обзор посвящен гальваническому элементу (батарейке) — химическому источнику электрического тока, основанному на взаимодействии двух металлов и (или) их оксидов в электролите, приводящих к возникновению в замкнутой цепи электрического тока. Мы подробно рассмотрим конструктивные особенности элемента, определимся с классификацией и разберемся, как работает батарейка.
История батарейки — гальванического элемента
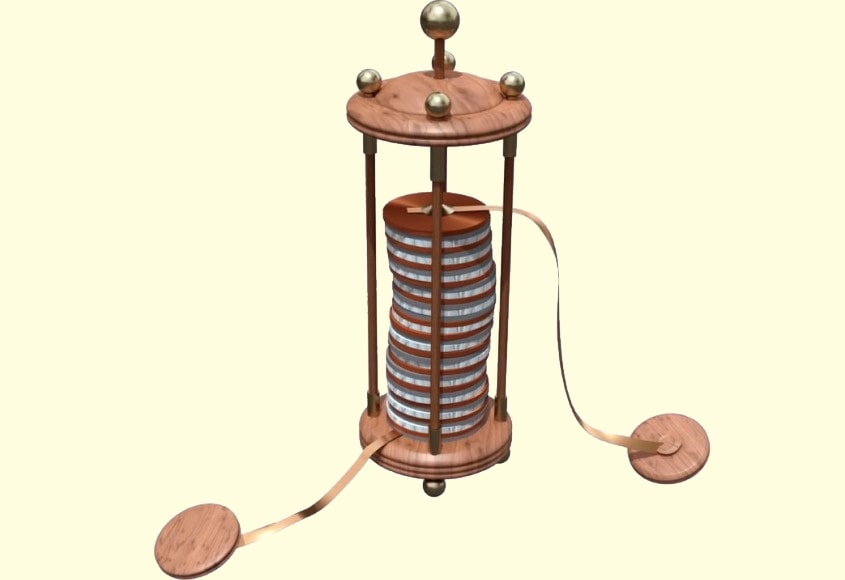
Александро Вольта предложил разделить все проводники на два рода:
- Сухие — металлы и уголь.
- Влажные — электролиты(влажные).
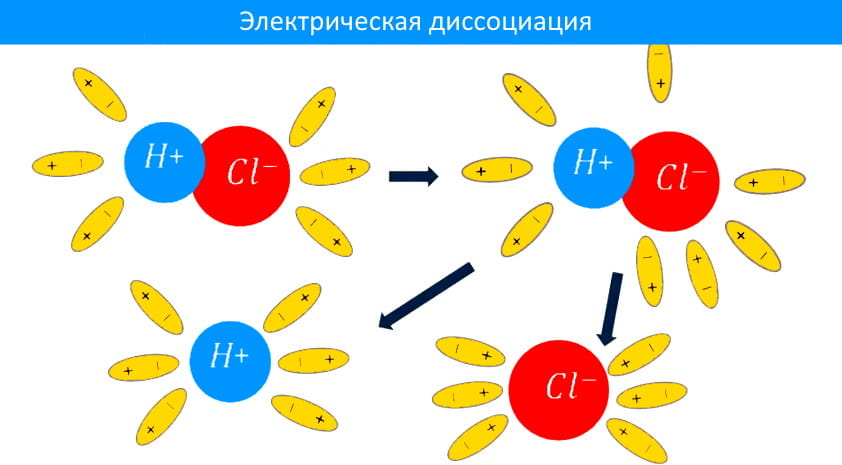
Шведский ученый Сванте Аррениус, изучая электропроводимость растворов различных веществ, в 1877 году пришел к выводу, что причиной электропроводимости является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электрической диссоциацией. При диссоциации в воде электролиты диссоциируют на положительно и отрицательно заряженные ионы. Под действием электрического поля, положительно заряженные ионы движутся к отрицательному полюсу источника тока (катоду) и называются катионами, а отрицательно заряженные – к положительному полюсу (аноду) и называются анионами. Таким образом электролиты обладают электронной проводимостью.
Примеры гальванических элементов:
| Название элемента | Отрицательный электрод | Положительный электрод | Электролит |
| Вольтов столб | Цинк | Медь | Раствор щелочи |
| Первый элемент Вольта | Цинк | Медь | Раствор серной кислоты |
| Элемент Даниэля | Цинк | Медь | Раствор сульфата цинка |
| Элемент Грине | Цинк | Угольный стержень | Раствор сульфата меди и бихромата калия |
| Элемент Лекланше | Цинковый цилиндр | Угольный стержень | Раствор нашатыря и оксид марганца |
| Сухой элемент | Цинковый цилиндр | Угольный стержень | Густой клейстер, приготовленный из муки на растворе нашатыря |
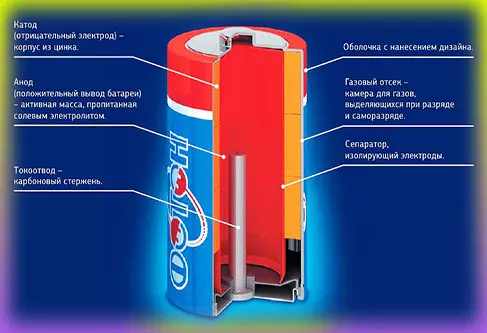
Эволюция батарейки — солевой гальванический элемент
Одним из первых гальванических элементов, которым можно было пользоваться вне лабораторий, была конструкция Жоржа Лекланше (1866 год). Она состояла из цинкового анода, катода из диоксида марганца с углем и электролита из хлорида аммония. Со временем элемент Лекланше эволюционировал в солевой (сухой) гальванический элемент следующим образом:
- Цинковый анод стал делаться в виде цинкового стаканчика.
- В стаканчике разместился катод из смеси диоксида марганца и графита.
- В центре катода находится угольный стержень, являющийся токосъемником (в некоторых источниках именно он неправильно называется катодом).
- Катод окружен электролитом из хлорида аммония с добавкой хлорида цинка.
- Электролит уже не в жидком виде, как у Лекланше, а в загущенном (гель). Это происходит путем добавления крахмала и муки, и необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента.
Конструкция сухой батареи:
 | 1 — воздушная прослойка |
| 2 — цинковый стакан | |
| 3 — электролит (NH4CL + ZnCl2) | |
| 4 — смесь графита и MnO2 | |
| 5 — угольный стержень | |
| 6 — защитный корпус |
Как работает сухая батарейка (солевой гальванический элемент)
Рассмотрим процессы, происходящие в сухом элементе. При потреблении тока электроны поступают через внешнюю электрическую цепь с цинкового электрода на угольный стержень. Происходят следующие реакции:
- Анод: Zn → Zn 2+ + 2e − .
- На угольном стержне электроны расходуются на восстановление H3O + — ионов. Катод: 2H3O + + 2e − → H2 + 2H2O.
- Ионы H3O + образуются в результате частичного протолиза NH4 + — ионов электролита: NH4 + + H2O ↔ H3O + + NH3.
- При восстановлении H3O + — ионов образуется водород, который не может удалиться (корпус герметичен) и образует вокруг угольного стержня прослойку газа (поляризация угольного электрода). Ток медленно затухает. Чтобы избежать образования водорода, угольный электрод окружают слоем диоксида марганца (MnO2). В присутствии диоксида марганца H3O + — ионы восстанавливаются с образованием воды. 2MnO2 + 2H3O + + 2e − → 2MnO (OH) + 2H2O. Таким способом избегают поляризации электрода, а диоксид марганца называют деполяризатором. Электролит NH4Cl диссоциирует и частично протолизируется.
- В общем: 2NH4Cl + 2H2O ↔ 2NH3 + 2H3O + + 2Cl − .
- Образующиеся на аноде ионы Zn 2+ поступают в раствор и образуют труднорастворимую соль Zn 2+ + 2NH3 + 2Cl − → [Zn (NH3)2]Cl2.
- Анод: Zn — 2e − → Zn 2+ .
- Катод: 2MnO2 + 2H3O + + 2e − → 2MnO (OH) + 2H2O.
- Раствор электролита: Zn 2+ + 2NH4 + + 2Cl − + 2H2O ↔ [Zn (NH3)2]Cl2 + 2H3O + .
- Общая реакция: Zn + 2MnO2 + 2NH4Cl → 2MnO (OH) + [Zn (NH3)2]Cl2.
Во время разрядки цинковый стакан растворяется. Во избежание вытекания электролита или продуктов реакции цинковый стакан имеет запас по толщине или окружен железной защитной оболочкой.
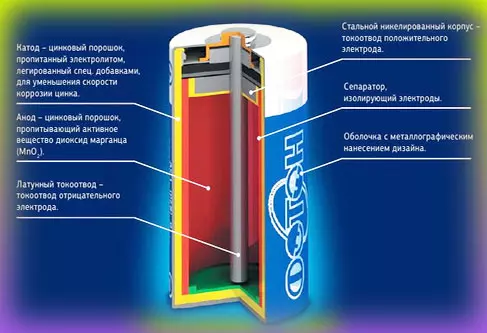
Что находится внутри щелочной батарейки
Впервые щелочные (алкалайновые) батарейки выпустила компания Eveready (Energizer) в 1959 году. Ее принципиальное отличие от сухой батарейки — состав электролита и конструкция. Электролит состоит не из соли аммония, как в солевой, а из раствора щелочи (обычно гидроксида калия). Конструкция элемента вывернута наизнанку по сравнению с конструкцией солевого элемента. То есть, если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента наоборот, корпус (+), а центральный токоотвод (-).
В солевых элементах при химической реакции расходуются все реагенты, составляющие этот элемент — анод, катод, электролит. А в щелочном элементе при химической реакции расходуется только анод и катод, электролит не расходуется. Поэтому электролита там совсем мало, и освободившееся место электролита заполнено увеличенным количеством анода и катода, что значительно увеличивает электроемкость щелочного элемента.
Типичная щелочная батарея выполнена в форме стального цилиндра, покрытого изолирующей пластиковой оболочкой. Положительный конец батарейки (катод) имеет выступающую наружу поверхность. Отрицательный конец (анод) — плоский. Эти две клеммы батарейки электрически изолированы друг от друга.
| 1 — никелированный стальной стакан | 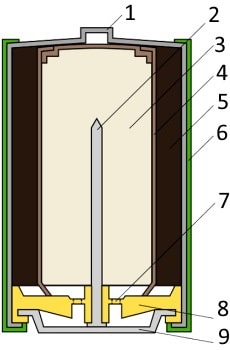 |
| 2 — латунный токосъемник | |
| 3 — анодная паста | |
| 4 — сепаратор | |
| 5 — катодная паста | |
| 6 — защитная оболочка | |
| 7 — предохранительная мембрана | |
| 8 — прокладка | |
| 9 — стальная тарелка |
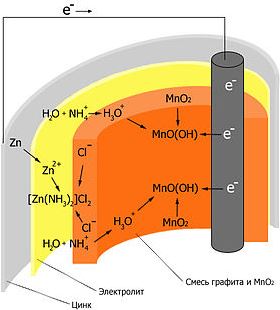
Корпус батарейки обычно делается из стали с никелевым покрытием. Внутри находится несколько слоев различных материалов, химические реакции которых создают определенные уровни напряжений и токов:
- Первый слой — это катод, представляющий собой смесь оксида марганца (MnO₂) и графита. Этот материал находится в контакте с металлом положительной клеммы. Графит добавляется для улучшения проводимости смеси и увеличения плотности энергии.
- Затем идет сепаратор — слой пористого материала, который образует барьер, предотвращающий прямой контакт анодного и катодного материалов друг с другом. В процессе производства на сепаратор распыляется щелочной электролит — гидроксид калия.
- С другой стороны барьера находится анод, который представляет собой пасту, изготовленную из цинкового порошка (Zn), а также желирующего агента. Желирующий агент поддерживает цинк во взвешенном состоянии, чтобы он не накапливался в одном месте.
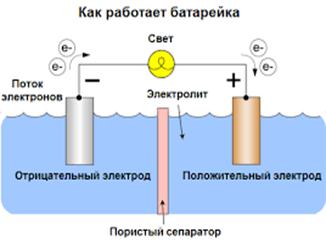
Как работает батарейка
Рассмотрим как работает электрическая батарейка и какие реакции взаимодействия происходят между ее химическими компонентами:
- Отрицательно заряженные ионы гидроксида (2OH-) взаимодействуют с цинком (Zn) в анодной секции. В результате химической реакции окисления получается гидроксид цинка (Zn(OH)2) и высвобождаются молекула воды и отрицательно заряженные электроны. Эти электроны теперь свободны для перемещения, и они собираются на латунном штыре (токоотводе отрицательного электрода).
- В то же время диоксида марганца (2MnO2) соединяется с молекулой воды (H2O) из электролита, а также со свободным электроном. Во время такой химической реакции восстановления диоксид марганца превращается в оксид марганца (Mn2O3). Оксид марганца больше не нуждается в атоме гидроксид-иона, поэтому он будет выбрасывать его в электролит.
- Таким образом, появляется скопление электронов на отрицательном конце батарейки. Поскольку больше отрицательно заряженных электронов на отрицательном полюсе по сравнению с положительным, образуется разность напряжений между ними, и эту разность можно измерить с помощью мультиметра.
- Электроны отталкиваются друг от друга и хотят переместиться в область с меньшим количеством электронов. Но сепаратор не позволяет им течь внутри батареи, чтобы достичь положительной клеммы. Если обеспечить электронам внешний путь (например подключив лампочку), то электроны будут течь через него и выполнять работу (заставлять лампу светится).
Пока есть полная цепь между выводами батарейки, химическая реакция будет продолжаться, и электроны будут течь от отрицательного клеммника к положительному. Если разорвать цепь, то химическая реакция прекратится.
Наглядно понять, как работает батарейка и что у нее происходит внутри, можно, ознакомившись с представленной ниже видео демонстрацией.
Как работает батарейка — видео
Химическая реакция в батарейке, к которой подключен потребитель:
- Свободные электроны поступают в батарею через положительную клемму.
- Они соединяются с оксидом марганца и молекулой воды на катоде, которая высвобождает ион гидроксида в электролит.
- Ион гидроксида проходит через сепаратор и соединяется с атомом цинка, образуя гидроксид цинка, и при этом высвобождаются электроны и молекула воды.
- Электроны хотят попасть в область с меньшим количеством электронов, так как положительная клемма имеет меньше электронов, поэтому они будут течь по проводу, чтобы достичь ее.
- Химическая реакция повторяется снова и снова до тех пор, пока не иссякнет ресурс батарейки.
Источник