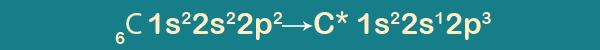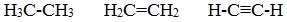Биогенные элементы / P-элементы / Углерод
Степень окисления:+4 Валентность во всех органических соединениях равна 4.
Углерод – органоген №1, так как:
Атомы углерода способны соединяться друг с другом, образуя цепи, линейные и циклические, различной длины и разветвленности.
Атом углерода имеет оптимальный радиус атома.
Среднее значение электроотрицательности углерода 2,5 позволяет ему образовывать связи и с более и менее электроотрицательными элементами.
Образует прочные ковалентные связи, способные к гомолитическому и гетеролитическому разрыву.
Химические превращения углерода и его соединений:
Топография w(С) в организме =21%, масса 14кг Топография: в ходит в состав всех клеток и тканей, так как является основой белков, жиров, углеводов, нуклеиновых кислот.
Физиологические функции и токсичность соединений углерода. Углекислый газ, СО2
Бесцветный газ, тяжелее воздуха, под давлением легко сжижается, может быть получен в твердом виде (сухой лед). В ходе метаболизма образуется 13 моль СО2 в сутки в результате окисления белков, жиров, углеводов:
Участвует в регуляции дыхания, являясь стимулятором дыхательного центра.
Участвует в регуляции кровообращения.
Участвует в реакциях карбоксилирования и декарбоксилирования.
Компонент гидрокарбонатной буферной системы.
В закрытых помещениях при увеличении объемной доли w(СО2) до 10% развивается ацидоз, одышка, так как равновесие процесса
сдвигается вправо, возрастает концентрация протонов, уменьшается рН.
В сутки образуется 10 мл в ходе метаболизма в процессе кроветворения. Продукт неполного сгорания углерода, газ без цвета и запаха, плохо растворим в воде, сильный восстановитель. Очень токсичен (БОВ), ПДК =0,03 мг/л В окружающей среде источником СО являются выхлопные газы автомобилей, промышленные газовые отходы, табачный дым.
Уменьшает кислородную емкость крови, связывая гемоглобин, => прекращается перенос кислорода, наступает асфиксия:
HHb + CO -> HHbCO HHbO2(оксигемоглобин)+CO HHbCO(карбонилгемоглобин, в 200 раз более) +O2
Главная мишень СО – миоглобин мышц; резко уменьшается содержание О2 в мышцах, нарушается работа мышечного аппарата.
Ингибирует каталазу, ферменты углеводного обмена, синтез АТФ.
Нарушает кислотно-щелочное равновесие и электролитный состав биожидкостей в клетках: уровень натрия повышается [Na+], уровень калия понижается [K+].
Снижается внимание и память.
Причиной отравления угарным газом является курение. Содержание карбонилгемоглобина в крови курильщиков, выкуривающих пачку сигарет в день, составляет 4,7%, у некурящих – всего 0,3-0,5% (от содержания гемоглобина). Причиной более сильного отравления может быть преждевременное закрытие заслонки печи или вдыхание выхлопных газов автомобиля. При легких отравлениях (содержание HHbCO в крови 10-15%) наблюдается головная боль, слабость, тошнота. При отравлениях средней степени (содержание HHbCO в крови 25-30%) нарушается координация движений, появляется синюшность кожи и помутнение сознания. При тяжелых отравлениях (содержание HHbCO в крови 60% и более) происходит потеря сознания, судороги. Смертельные концентрации СО составляют 2 мг/л при 60-минутной и 5мг/л при 5-минутной экспозиции. Лечение при отравлении СО проводят в барокамерах, увеличивая р(О2) до 3 атм. для выведения СО из крови.
В организме образуются при окислении аминокислот под действием аминооксидаз. В окружающую среду попадают из гальванических производств.
Токсическое действие цианидов:
Ферменты, содержащие железо (каталаза, пероксидаза, цитохромы дыхательной цепи), инактивируются, прекращается перенос электронов на О2, смерть наступает от остановки тканевого дыхания, хотя в крови много О2, но он не используется.
Главная мишень цианидов – мозг, так как в печени происходит процесс:
CN-+S -> SCN-(роданид, не токсичен)
Роданистоводородная кислота, HCNS Не токсична, содержится в слюне, обладает бактерицидным действием.
С – активированный уголь – адсорбент при метеоризме, пищевых интоксикациях, отравлениях.
СО2+О2 – возбудитель дыхательного центра после наркоза.средство
СО2(твердый) – в дерматологии для вымораживания.
NaHCO3– питьевая сода, антацидное:
и антисептическое средство:
HCO 3– + HOH -> OH–(щелочная среда) + H2CO3
Источник
3. Особенности органических соединений
В отличие от неорганических веществ органические вещества имеют ряд характерных особенностей:
1) атомы углерода способны соединяться друг с другом;
2) образуют цепи и кольца, что не так типично для неорганических соединений. Это одна из причин многообразия органических соединений;
3) одной из важных особенностей органических соединений, которая накладывает отпечаток на все их химические свойства, является характер связей между атомами в их молекулах.
Эти связи имеют ярко выраженный ковалентный характер. Органические вещества в большинстве неэлектролиты, не диссоциируют в растворах на ионы и сравнительно медленно взаимодействуют друг с другом.
Время, необходимое для завершения реакций между органическими веществами, измеряется часами, а иногда и днями.
Если ионные (неорганические) соединения легко диссоциируют в воде на ионы и реакции между ними протекают весьма быстро, то органические вещества, содержащие простые (одинарные) С – С и С – Н связи, взаимодействуют между собой с большим трудом.
При нагревании в пределах 400–600 °C органические соединения полностью разлагаются и обугливаются, а в присутствии кислорода сгорают. Это объясняется сравнительно небольшой прочностью связи между атомами углерода (355,6 кДж/моль);
4) важной особенностью органических соединений является и то, что среди них широко распространено явление изомерии;
5) имеется множество соединений углерода, которые обладают одинаковым качественным и количественным составом и одинаковой молекулярной массой, но совершенно различными физическими и даже химическими свойствами;
6) многие органические соединения являются непосредственными носителями, участниками или продуктами процессов, которые протекают в живых организмах, – ферменты, гормоны, витамины.
Особенности атома углерода объясняются его строением:
1) он имеет четыре валентных электрона;
2) атомы углерода образуют с другими атомами, а также друг с другом общие электронные пары. При этом на внешнем уровне каждого атома углерода будет восемь электронов (октет), четыре из которых одновременно принадлежат другим атомам.
В органической химии обычно пользуются структурными формулами, поскольку атомы имеют пространственное расположение в молекуле.
Структурные формулы – это язык органической химии.
В структурных формулах ковалентная связь обозначается черточкой. Как и в структурных формулах неорганических веществ, каждая черточка означает общую электронную пару, связывающую атомы в молекуле. Используются также эмпирические и электронные формулы.
4. Теория химического строения органических соединений а.М. Бутлерова
Крупнейшим событием в развитии органической химии было создание в 1961 г. великим русским ученым А.М. Бутлеровым теории химического строения органических соединений.
До А.М. Бутлерова считалось невозможным познать строение молекулы, т. е. порядок химической связи между атомами. Многие ученые даже отрицали реальность атомов и молекул.
А.М. Бутлеров опроверг это мнение. Он исходил из правильных материалистических и философских представлений о реальности существования атомов и молекул, о возможности познания химической связи атомов в молекуле. Он показал, что строение молекулы можно установить опытным путем, изучая химические превращения вещества. И наоборот, зная строение молекулы, можно вывести химические свойства соединения.
Теория химического строения объясняет многообразие органических соединений. Оно обусловлено способностью четырехвалентного углерода образовывать углеродные цепи и кольца, соединяться с атомами других элементов и наличием изомерии химического строения органических соединений. Эта теория заложила научные основы органической химии и объяснила ее важнейшие закономерности. Основные принципы своей теории А.М. Бутлеров изложил в докладе «О теории химического строения».
Основные положения теории строения сводятся к следующему:
1) в молекулах атомы соединены друг с другом в определенной последовательности в соответствии с их валентностью. Порядок связи атомов называется химическим строением;
2) свойства вещества зависят не только от того, какие атомы и в каком количестве входят в состав его молекулы, но и от того, в каком порядке они соединены между собой, т. е. от химического строения молекулы;
3) атомы или группы атомов, образовавшие молекулу, взаимно влияют друг на друга.
В теории химического строения большое внимание уделяется взаимному влиянию атомов и групп атомов в молекуле.
Химические формулы, в которых изображен порядок соединения атомов в молекулах, называются структурными формулами или формулами строения.
Значение теории химического строения А.М. Бутлерова:
1) является важнейшей частью теоретического фундамента органической химии;
2) по значимости ее можно сопоставить с Периодической системой элементов Д.И. Менделеева;
3) она дала возможность систематизировать огромный практический материал;
4) дала возможность заранее предсказать существование новых веществ, а также указать пути их получения.
Теория химического строения служит руководящей основой во всех исследованиях по органической химии.
Источник
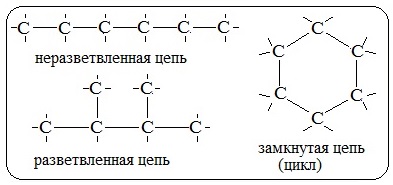
Атомы углерода способны соединяться друг с другом в различные цепи
Углерод — особый элемент. Ни один другой химический элемент не способен образовывать такое многообразие соединений. Причина этого многообразия в том, что атомы углерода способны:
1) соединяться друг с другом в цепи различного строения: открытые (неразветвленные, разветвленные), замкнутые:
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняются сочетанием двух факторов:
— наличие на внешнем энергетическом уровне (2s и 2p) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов);
— малый размер атома (в сравнении с другими элементами IV группы).
Вследствие этого углерод образует главным образом ковалентные, а не ионные связи, и проявляет валентность, равную 4.
Многообразие углеводородов
В силу особенностей строения и свойств углерода его соединения с водородом очень многочисленны и разнообразны:
1. Атомы углерода способны соединяться между собой в цепи различного строения:
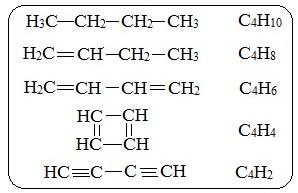
2. При одинаковом количестве атомов углерода в молекулах углеводороды могут отличаться числом атомов водорода.
Например, соединения с 4-мя атомами углерода могут содержать от 10-ти до 2-х атомов водорода:
3. Одному и тому же элементному составу молекул (одной молекулярной формуле) может соответствовать несколько различных веществ – изомеров. Например, молекулярную формулу С4Н8 имеют 6 изомерных соединений:
Источник